Fenol – właściwości, zastosowanie i zagrożenia związane z tym związkiem chemicznym
Czym jest fenol i jakie ma właściwości chemiczne?
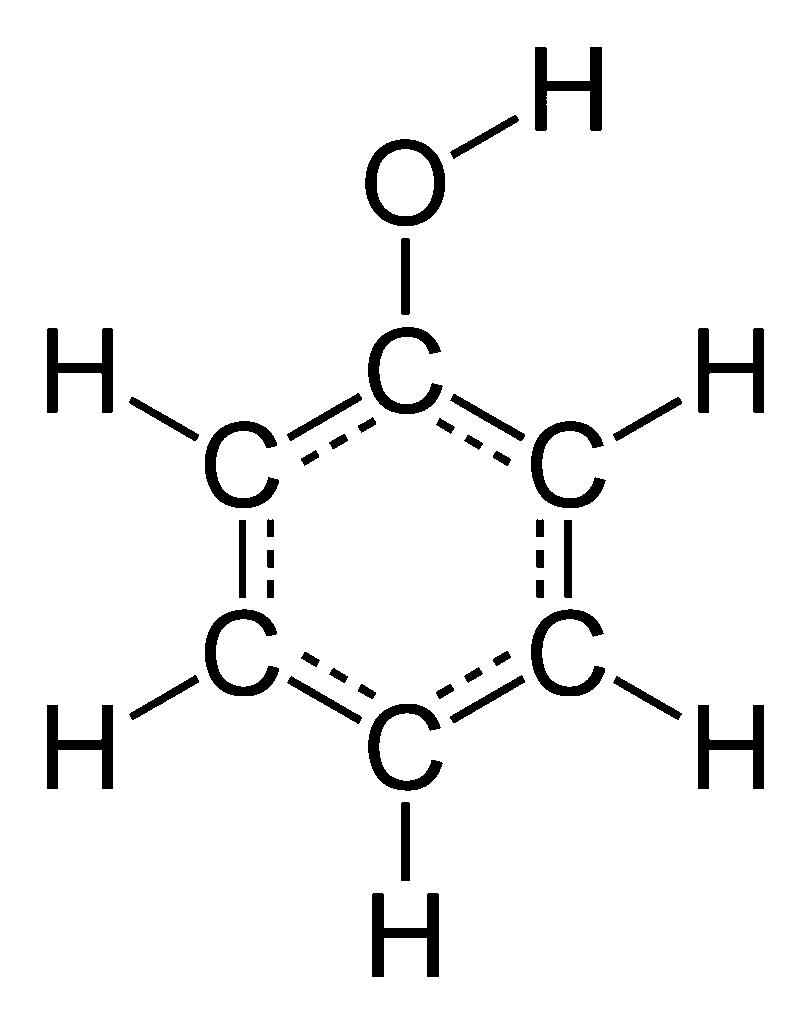
Budowa cząsteczki i wzór fenolu
Fenol to organiczny związek chemiczny należący do grupy hydroksybenzenów, czyli związków zawierających pierścień aromatyczny połączony z grupą hydroksylową (–OH). Jego wzór sumaryczny to C₆H₅OH, a strukturalnie można go zapisać jako benzen z podstawioną grupą –OH. Pomimo obecności grupy hydroksylowej, fenol różni się istotnie od typowych alkoholi – właśnie ze względu na bezpośrednie połączenie grupy –OH z pierścieniem aromatycznym.
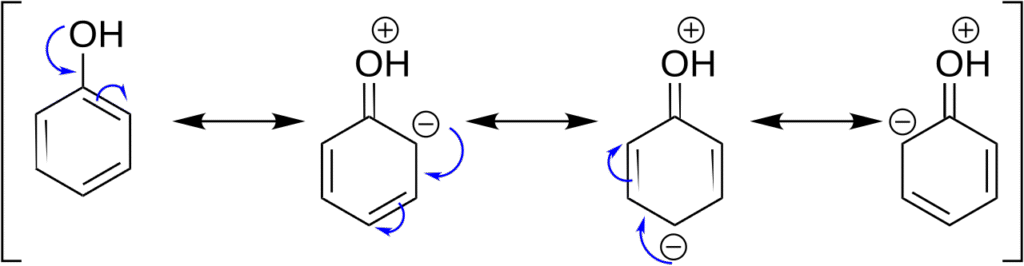
Cząsteczka fenolu jest płaska, a jego układ elektronowy sprzyja delokalizacji ładunku ujemnego z grupy hydroksylowej do pierścienia benzenowego. To zjawisko wpływa na unikalne właściwości chemiczne fenolu – szczególnie na jego kwasowość, reaktywność elektrofilową oraz zdolność do tworzenia wiązań wodorowych.
Podstawowe dane chemiczne fenolu:
- masa molowa: 94,11 g/mol,
- wzór strukturalny: C₆H₅OH,
- klasyfikacja: związek aromatyczny, jednofunkcyjny fenol.
Właściwości fizyczne fenolu
Fenol w temperaturze pokojowej przyjmuje postać bezbarwnych lub lekko różowych kryształów. Jego barwa może się zmieniać w wyniku długiego kontaktu z powietrzem lub światłem – pojawia się wtedy lekkie brunatnienie, spowodowane utlenianiem i tworzeniem związków barwnych.
Najważniejsze właściwości fizyczne fenolu:
- temperatura topnienia: około 40–43°C,
- temperatura wrzenia: około 181–182°C,
- gęstość: 1,07 g/cm³,
- rozpuszczalność w wodzie: umiarkowana – około 8,3 g/100 ml w temperaturze 20°C, rośnie wraz ze wzrostem temperatury,
- rozpuszczalność w rozpuszczalnikach organicznych: bardzo dobra – etanol, eter, chloroform, aceton.
Fenol wykazuje słabe właściwości kwasowe – pKa wynosi ok. 10, co oznacza, że może reagować z mocnymi zasadami tworząc fenolany (np. C₆H₅ONa – fenolan sodu). Jego kwasowość jest wyraźnie wyższa niż typowych alkoholi (etanol ma pKa ≈ 15), co wynika z stabilizacji anionu fenolanowego przez rezonans.
Charakterystyczną cechą fenolu jest jego intensywny, ostry, lekko słodkawy zapach, przypominający zapach leków lub środków antyseptycznych. Już niewielkie ilości par fenolu są wyczuwalne przez ludzki nos, co czyni go wyczuwalnym i nieprzyjemnym w pracy bez odpowiedniej wentylacji.
Różnice między fenolem a klasycznymi alkoholami
Mimo że fenol zawiera grupę hydroksylową, jego właściwości znacząco odbiegają od klasycznych alkoholi alifatycznych (np. metanol, etanol). Główne różnice wynikają z interakcji grupy –OH z pierścieniem benzenowym, która zmienia zarówno elektroujemność tlenu, jak i polaryzację wiązania O–H.
Najważniejsze różnice:
- kwasowość: fenol jest znacznie bardziej kwasowy niż alkohole – może reagować z wodorotlenkami, podczas gdy alkohole tego nie robią,
- reaktywność: fenol łatwo ulega elektrofilowej substytucji aromatycznej – głównie w pozycjach orto i para względem grupy –OH (np. halogenowanie, nitrowanie, sulfonowanie),
- utlenianie: fenol utlenia się znacznie łatwiej niż alkohole – nawet tlenem z powietrza, co prowadzi do powstawania barwnych produktów utlenienia, np. chinonów,
- właściwości antyseptyczne: fenol działa bakteriobójczo i grzybobójczo – alkohole etylowy czy izopropylowy też mają działanie odkażające, ale fenol był pierwszym środkiem tego typu używanym w chirurgii.
Fenol to pierwszy związek organiczny, który był stosowany jako środek antyseptyczny, co zawdzięcza swoim unikalnym właściwościom chemicznym – zwłaszcza zdolności do denaturacji białek i niszczenia błon komórkowych mikroorganizmów.
Reaktywność chemiczna fenolu
Fenol uczestniczy w wielu istotnych reakcjach chemicznych, które stanowią fundament syntezy organicznej. Do najważniejszych należą:
- tworzenie soli fenolanowych poprzez reakcję z zasadami,
- reakcja z chlorkiem acylowym lub bezwodnikiem kwasowym – prowadząca do powstania estrów fenolowych (np. aspiryna to ester kwasu salicylowego),
- reakcje elektrofilowej substytucji aromatycznej – grupa –OH aktywuje pierścień benzenowy, co powoduje, że fenol bardzo łatwo reaguje z bromem, kwasem azotowym czy siarkowym:
- C₆H₅OH + Br₂ → 2,4,6-tribromofenol
- C₆H₅OH + HNO₃ → nitrofenole (np. orto-, para-nitrofenol),
- utlenianie do chinonów i innych związków karbonylowych – istotne w biochemii i analizie chemicznej.
Fenol również bardzo dobrze kompleksuje się z niektórymi jonami metali (np. Fe³⁺), tworząc barwne kompleksy, co wykorzystywane jest w analizie jakościowej do wykrywania obecności fenoli w próbce.
Znaczenie fenolu jako związku modelowego
Fenol odgrywa niezwykle ważną rolę w chemii teoretycznej i praktycznej jako związek modelowy dla badań nad:
- właściwościami elektronowymi pierścienia aromatycznego,
- wpływem podstawników na reaktywność cząsteczki,
- mechanizmami substytucji elektrofilowej,
- właściwościami kwasowo-zasadowymi i równowagami chemicznymi w roztworach organicznych,
- dynamiką reakcji katalizowanych enzymatycznie – np. w badaniach nad oksydazami i peroksydazami.
W kolejnej części artykułu przyjrzymy się praktycznym zastosowaniom fenolu, zarówno w przemyśle chemicznym i farmaceutycznym, jak i w produkcji codziennych materiałów – od plastiku po środki czystości.
Zastosowanie fenolu w przemyśle i laboratoriach
Produkcja tworzyw sztucznych i żywic fenolowo-formaldehydowych
Jednym z najważniejszych i najbardziej rozpowszechnionych zastosowań fenolu jest jego udział w produkcji tworzyw sztucznych, zwłaszcza tzw. fenoplastów – czyli żywic fenolowo-formaldehydowych. Reakcja fenolu z formaldehydem prowadzi do powstania trwałych i wytrzymałych materiałów polimerowych, które znajdują zastosowanie w wielu dziedzinach techniki.
Żywice fenolowo-formaldehydowe są wykorzystywane m.in. do:
- produkcji płyt laminowanych,
- wytwarzania izolatorów elektrycznych,
- jako spoiwa w materiałach ciernych (np. klockach hamulcowych),
- produkcji klejów i kompozytów,
- tworzenia narzędzi i części maszyn odpornych na wysoką temperaturę i chemikalia.
Fenol jest również stosowany jako surowiec w produkcji bisfenolu A (BPA) – związku pośredniego w syntezie poliwęglanów i żywic epoksydowych. BPA powstaje w wyniku kondensacji fenolu z acetonem i jest wykorzystywany do wytwarzania:
- przezroczystych tworzyw odpornych na uderzenia (np. soczewek okularowych, osłon urządzeń),
- trwałych powłok ochronnych i farb proszkowych,
- powłok wewnętrznych w puszkach spożywczych i rurach wodociągowych.
Mimo kontrowersji związanych z potencjalnym działaniem BPA jako związku zaburzającego gospodarkę hormonalną, jego zastosowanie w przemyśle chemicznym i materiałowym nadal pozostaje bardzo szerokie, a fenol stanowi fundament tej produkcji.
Fenol jako prekursor w syntezie chemicznej
Fenol jest kluczowym substratem w syntezie organicznej, gdzie służy jako punkt wyjścia do otrzymywania licznych związków chemicznych – zarówno prostych, jak i bardzo złożonych. Dzięki swojej reaktywności wobec czynników elektrofilowych, a także zdolności do tworzenia soli i estrów, fenol bierze udział w reakcjach prowadzących do uzyskania:
- barwników i pigmentów – np. azobarwników poprzez reakcję diazowania i sprzęgania,
- środków konserwujących i dezynfekcyjnych – takich jak fenolan sodu, chlorofenole, hexachlorofen,
- substancji leczniczych – np. salolu (fenylooctanu fenylu), paracetamolu (acetaminofenu), aspiryny (kwasu acetylosalicylowego poprzez salicylany),
- inhibitorów korozji, dodatków do smarów i olejów,
- środków ochrony roślin – np. herbicydów i fungicydów pochodzenia fenolowego.
Fenol w reakcjach chemicznych może pełnić zarówno rolę nukleofila (dzięki parze elektronowej na tlenie), jak i aktywatora pierścienia aromatycznego, co czyni go niezwykle wszechstronnym prekursorem do tworzenia związków o bardzo zróżnicowanych właściwościach.
Zastosowania w medycynie i kosmetyce
Chociaż dziś fenol nie jest już szeroko stosowany jako bezpośredni środek antyseptyczny, to jego działanie bakteriobójcze i przeciwgrzybicze zapisało się w historii medycyny. W XIX wieku Joseph Lister stosował fenol (znany wtedy jako karbol) do odkażania narzędzi chirurgicznych i ran, co przyczyniło się do drastycznego zmniejszenia śmiertelności operacyjnej i zapoczątkowało nowoczesną aseptykę.
Obecnie fenol i jego pochodne są stosowane w:
- leczniczych maściach i preparatach odkażających,
- produktach przeciwtrądzikowych i peelingach chemicznych (np. zabiegach fenolowych na przebarwienia i blizny),
- płynach do dezynfekcji jamy ustnej i gardła – w bardzo niskich stężeniach,
- preparatach stomatologicznych – jako środek antyseptyczny i utrwalający w leczeniu kanałowym,
- chirurgii dermatologicznej – do leczenia wrastających paznokci i brodawek.
Fenol stosowany w kosmetyce i farmacji musi być ściśle kontrolowany pod względem stężenia, ponieważ działa drażniąco na skórę i śluzówki. Zazwyczaj wykorzystuje się jego pochodne, takie jak krezole, salicylany czy rezorcynol, które są łagodniejsze, a zarazem skuteczne.
W medycynie estetycznej fenolowy peeling chemiczny uważany jest za jeden z najbardziej inwazyjnych, ale i najskuteczniejszych zabiegów głębokiej odnowy skóry. Polega on na aplikacji roztworu fenolu na skórę twarzy, co powoduje złuszczenie naskórka i pobudzenie regeneracji głębszych warstw skóry. Zabieg ten wykonuje się tylko w warunkach medycznych, ze względu na ryzyko toksycznego działania fenolu wchłanianego przez skórę.
Inne zastosowania przemysłowe i specjalistyczne
Fenol znajduje także zastosowanie w mniej oczywistych dziedzinach, takich jak:
- produkcja środków czystości i odtłuszczaczy przemysłowych,
- usuwanie nieprzyjemnych zapachów,
- produkcja papieru i włókien syntetycznych,
- analityka chemiczna – wykrywanie żelaza(III) poprzez reakcję z fenolem (powstaje czerwony kompleks),
- produkcja materiałów wybuchowych – np. pikrynianów.
W laboratoriach fenol stosowany jest także jako reagent do izolacji RNA w biologii molekularnej – w połączeniu z chloroformem i izotiocyjanianem guanidyny pozwala na skuteczną ekstrakcję kwasów nukleinowych z komórek i tkanek.
Wszechstronność fenolu sprawia, że mimo swojej toksyczności i nieprzyjemnego zapachu, pozostaje on jednym z najbardziej użytecznych związków organicznych w przemyśle chemicznym, farmaceutycznym i badaniach naukowych. W kolejnej części artykułu przedstawione zostaną szczegóły dotyczące toksyczności, zasad bezpiecznego obchodzenia się z fenolem oraz postępowania w sytuacjach awaryjnych.
Toksyczność fenolu i zasady bezpiecznego obchodzenia się z nim
Wpływ fenolu na organizm człowieka
Fenol jest związkiem toksycznym, który może działać szkodliwie już przy bardzo niewielkich stężeniach. Do organizmu człowieka może wniknąć przez skórę, drogi oddechowe i przewód pokarmowy. Najbardziej niebezpieczne są długotrwały kontakt skórny oraz wdychanie jego par – zwłaszcza w warunkach słabej wentylacji.
Objawy zatrucia fenolem zależą od dawki i drogi kontaktu. W przypadku kontaktu ze skórą może dojść do:
- silnego podrażnienia i zaczerwienienia,
- bólu, pieczenia,
- martwicy tkanek i głębokich oparzeń chemicznych,
- wieloogniskowego uszkodzenia naskórka i skóry właściwej, nawet po krótkim kontakcie z niechronioną powierzchnią ciała.
Wdychanie oparów fenolu wywołuje:
- kaszel, duszność i uczucie pieczenia w nosie i gardle,
- ból głowy, zawroty głowy, zaburzenia równowagi,
- senność, dezorientację i obniżenie świadomości,
- w wyższych stężeniach – porażenie ośrodka oddechowego, drgawki i śpiączkę.
Spożycie fenolu lub jego pochodnych (nawet niewielkich ilości) prowadzi do:
- silnego bólu w jamie ustnej i przełyku,
- wymiotów, biegunki, skurczów brzucha,
- zaburzeń krążenia i pracy serca,
- uszkodzenia wątroby i nerek,
- w skrajnych przypadkach – do śmierci w wyniku niewydolności wielonarządowej.
Fenol jest także neurotoksyną – wchłonięty przez skórę lub błony śluzowe może prowadzić do uszkodzeń komórek nerwowych, zaburzeń pamięci, a w przypadku przewlekłego narażenia – do trwałych zmian neurologicznych.
Ochrona zdrowia przy pracy z fenolem
Ze względu na swoją toksyczność i drażniące działanie, fenol należy do grupy substancji chemicznych, z którymi wolno pracować wyłącznie w odpowiednio przystosowanych warunkach laboratoryjnych. Przestrzeganie ścisłych zasad BHP jest absolutną koniecznością.
Podstawowe środki ostrożności:
- praca wyłącznie w dygestorium lub komorze laminarnym, z wydajną wentylacją,
- stosowanie rękawic odpornych na chemikalia (np. nitrylowych lub butylowych) – lateks nie chroni skutecznie przed penetracją fenolu,
- noszenie okularów ochronnych lub przyłbicy, aby zabezpieczyć oczy przed rozpryskami,
- używanie fartuchów laboratoryjnych, odzieży z długimi rękawami oraz obuwia zakrytego,
- unikanie bezpośredniego kontaktu ze skórą – nawet niewielkie ilości fenolu mogą szybko wchłonąć się do krwiobiegu, powodując ogólnoustrojowe zatrucie.
W razie kontaktu fenolu ze skórą należy natychmiast:
- zdjąć zanieczyszczoną odzież,
- przemyć skórę dużą ilością letniej wody,
- natychmiast skontaktować się z lekarzem,
- w razie potrzeby – hospitalizacja i obserwacja w kierunku toksycznego uszkodzenia nerek i układu nerwowego.
Nie zaleca się stosowania typowych środków odkażających (np. spirytusu) na miejsca poparzone fenolem – może to pogorszyć wchłanianie substancji.
Przechowywanie fenolu i zasady transportu
Fenol należy przechowywać zgodnie z przepisami dotyczącymi substancji toksycznych i łatwopalnych. Zalecenia obejmują:
- szczelne, oznaczone pojemniki z etykietą ostrzegawczą, najlepiej wykonane ze szkła ciemnego lub tworzywa odpornego na utlenianie,
- przechowywanie w chłodnym, suchym, dobrze wentylowanym pomieszczeniu, z dala od światła, źródeł ciepła i materiałów łatwopalnych,
- unikanie długiego kontaktu z powietrzem – fenol utlenia się do związków brunatnych i może tracić aktywność chemiczną,
- nieprzechowywanie fenolu w lodówkach przeznaczonych do żywności lub leków, nawet w laboratoriach biologicznych,
- kontrolowanie dat ważności i warunków przechowywania – zużycie tylko z datowanych, sprawdzonych partii.
W transporcie fenol klasyfikowany jest jako substancja niebezpieczna (ADR – klasa 6.1: toksyczne), a jego przewóz wymaga odpowiednich zezwoleń, opakowań oraz oznakowania. Zabronione jest przesyłanie fenolu zwykłymi środkami kurierskimi bez spełnienia wymagań ADR i RID.
Postępowanie w przypadku skażenia lub wycieku
Jeśli dojdzie do rozlania fenolu:
- należy natychmiast ewakuować osoby z zagrożonej strefy,
- założyć rękawice ochronne, maskę z filtrem par organicznych, gogle i fartuch kwasoodporny,
- zabezpieczyć miejsce i przysypać substancję chłonną (np. wermikulitem, piaskiem, sorbentem chemicznym),
- użyć neutralizatora – np. roztworu wodorowęglanu sodu lub amoniaku, jeśli wskazane,
- zebrać zanieczyszczenia do szczelnych pojemników i oznaczyć jako odpady niebezpieczne,
- dokładnie przewietrzyć pomieszczenie i poinformować osoby odpowiedzialne za BHP.
W przypadku większych wycieków należy skontaktować się z jednostką chemiczną straży pożarnej lub laboratorium dysponującym systemem dekontaminacyjnym.
Zagrożenia środowiskowe i regulacje prawne
Fenol jest nie tylko toksyczny dla ludzi, ale również niebezpieczny dla środowiska wodnego. Już w stężeniach rzędu mg/L może powodować śmierć organizmów wodnych, a jego obecność w ściekach przemysłowych musi być stale monitorowana i neutralizowana przed odprowadzeniem do kanalizacji.
Substancja ta podlega ścisłym regulacjom prawnym:
- klasyfikacja REACH i CLP: substancja toksyczna, drażniąca, działająca mutagennie,
- konieczność rejestracji w bazach substancji chemicznych,
- obowiązek posiadania kart charakterystyki (SDS) i oznakowania zgodnie z GHS,
- ograniczenia stosowania w przemyśle kosmetycznym i farmaceutycznym w zależności od kraju.
Świadomość ryzyka, jakie niesie ze sobą fenol, jest niezbędna do jego bezpiecznego użytkowania. Dzięki ściśle przestrzeganym procedurom BHP, regularnym szkoleniom i właściwemu przechowywaniu, można korzystać z jego wartości chemicznej, minimalizując jednocześnie zagrożenie dla zdrowia ludzi i środowiska. Fenol, choć groźny, pozostaje nieodzownym narzędziem w rękach doświadczonego chemika.
FAQ fenol – najczęstsze pytania
Co to jest fenol?
Fenol to organiczny związek chemiczny o wzorze C₆H₅OH, zbudowany z pierścienia benzenowego połączonego z grupą hydroksylową. Jest podstawowym przedstawicielem hydroksybenzenów.
Jakie są właściwości fizyczne fenolu?
Fenol to bezbarwna lub lekko różowa krystaliczna substancja o charakterystycznym, drażniącym zapachu. Topi się w temperaturze około 40°C i ma właściwości słabo kwasowe.
Do czego używa się fenolu?
Fenol wykorzystuje się w produkcji tworzyw sztucznych, barwników, leków, pestycydów i środków dezynfekujących. Jest również ważnym półproduktem w syntezie organicznej.
Czy fenol jest niebezpieczny?
Tak, fenol działa toksycznie na skórę, układ nerwowy i oddechowy. Może powodować poparzenia chemiczne i objawy zatrucia przy wdychaniu lub połknięciu. Wymaga ostrożnego obchodzenia się.
Jak przechowywać fenol?
Fenol należy przechowywać w szczelnie zamkniętych pojemnikach, w chłodnym i dobrze wentylowanym miejscu, z dala od źródeł ognia i materiałów utleniających.
- Lamele ścienne – praktyczny i estetyczny materiał do nowoczesnych aranżacji wnętrz - 30 października, 2025
- Jak wybrać idealny sweter męski rozpinany? 4 wskazówki - 1 października, 2025
- BREEAM – praktyczny przewodnik po certyfikacji zrównoważonych budynków - 24 września, 2025




Opublikuj komentarz