Metyloamina – właściwości, zastosowania i znaczenie w chemii organicznej
Co to jest metyloamina i jak wygląda jej budowa chemiczna
Wzór sumaryczny metyloaminy i jej klasyfikacja jako amina
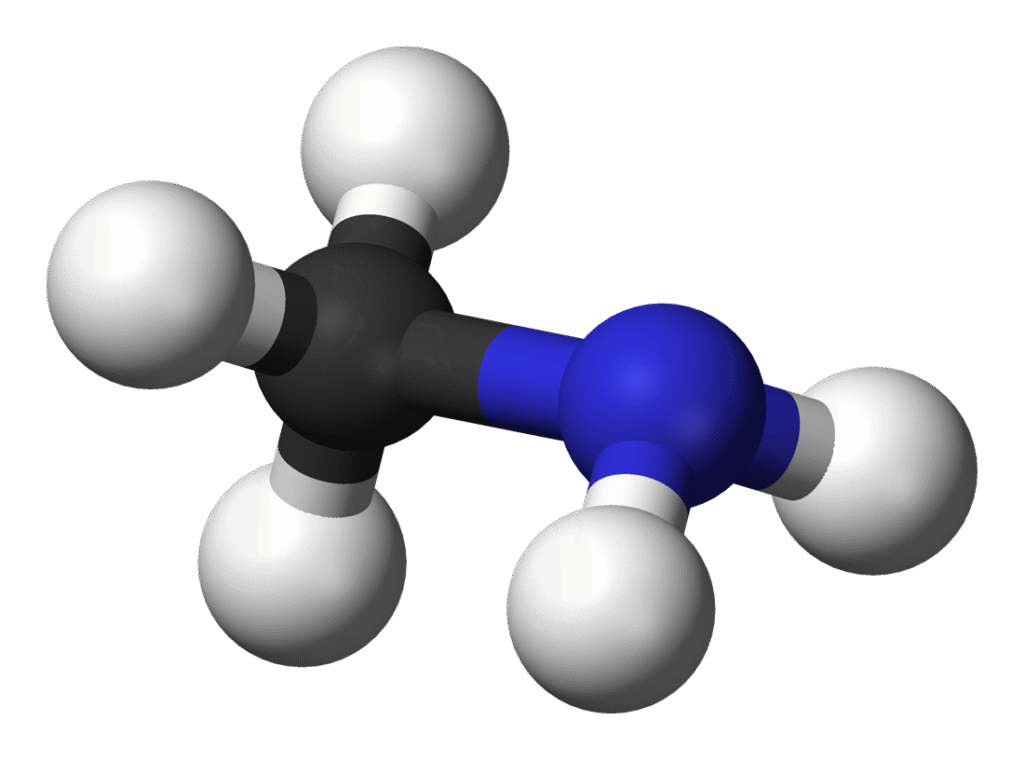
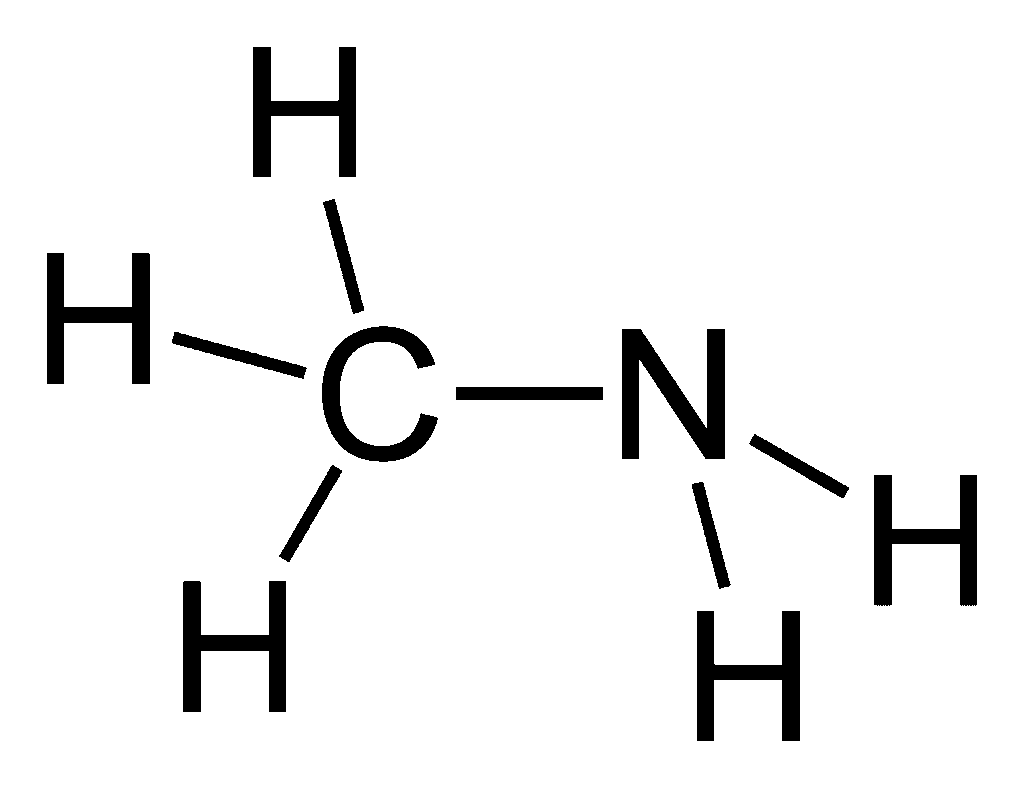
Metyloamina to organiczny związek chemiczny, należący do grupy amin alifatycznych. Jej wzór sumaryczny to CH₅N, a rozwinięty zapis strukturalny to CH₃NH₂. Oznacza to, że jest to amina pierwszorzędowa, w której jeden atom wodoru w cząsteczce amoniaku został zastąpiony grupą metylową (–CH₃). Pozostałe dwa atomy wodoru pozostają związane z atomem azotu, co pozwala jej nadal wykazywać cechy typowe dla amin – zdolność do tworzenia wiązań wodorowych, reaktywność zasadową oraz zdolność do tworzenia soli z kwasami.
Metyloamina jest jednym z najprostszych związków zawierających grupę aminową, co czyni ją ważnym punktem odniesienia w chemii organicznej i biochemii. Podobnie jak inne aminy alifatyczne, metyloamina wykazuje charakter zasadowy – wynika to z obecności wolnej pary elektronowej na atomie azotu, która umożliwia przyłączanie protonu (H⁺).
Jej podstawowa klasyfikacja chemiczna to:
- organiczna zasada Lewisa,
- amina pierwszorzędowa,
- związek lotny i higroskopijny,
- reaktywna pochodna amoniaku.
Ze względu na niską masę molową (31,06 g/mol), metyloamina jest substancją bardzo lotną i silnie aktywną chemicznie, co sprawia, że znajduje zastosowanie w wielu procesach przemysłowych i laboratoryjnych.
Struktura cząsteczki i porównanie z innymi aminami
Struktura metyloaminy to klasyczny przykład czterowiązalnego atomu azotu z wolną parą elektronową, ułożonego w układzie tetraedrycznym. Wokół azotu znajdują się:
- jedna grupa metylowa (–CH₃),
- dwa atomy wodoru (–H),
- jedna wolna para elektronowa.
Układ tych grup wokół azotu powoduje, że cząsteczka metyloaminy ma kształt piramidy trygonalnej, bardzo podobny do cząsteczki amoniaku (NH₃), ale nieco zmodyfikowany przez obecność grupy alkilowej. Obecność tej grupy zwiększa polaryzowalność cząsteczki, wpływa na rozpuszczalność i właściwości zasadowe, ale też na zapach i palność.
W porównaniu z innymi aminami:
- amoniak (NH₃) jest bardziej lotny i mniej hydrofobowy,
- dimetyloamina (CH₃)₂NH jest bardziej zasadowa i bardziej hydrofobowa,
- trimetyloamina (CH₃)₃N nie może tworzyć wiązań wodorowych z wodą jako donor i ma niższą rozpuszczalność w wodzie.
Metyloamina znajduje się więc na interesującym pograniczu właściwości hydrofilowych i hydrofobowych – z jednej strony łatwo się rozpuszcza w wodzie, z drugiej jednak jest wystarczająco nielotna i organiczna, by wykazywać typowe właściwości chemiczne estrów, amin i innych związków organicznych.
Naturalne występowanie i metody otrzymywania
Choć metyloamina jest głównie wytwarzana syntetycznie, występuje również naturalnie w przyrodzie, głównie jako produkt rozkładu białek i aminokwasów w procesach gnilnych. Można ją wykryć w:
- tkankach zwierzęcych jako produkt katabolizmu (np. w wątrobie, nerkach, jelitach),
- rybach i owocach morza, gdzie przyczynia się do charakterystycznego „rybiego” zapachu po zepsuciu,
- fermentujących produktach spożywczych,
- w organizmach roślinnych jako część metabolizmu azotu.
W przemyśle metyloamina otrzymywana jest na kilka sposobów, przy czym najważniejsze to:
- Aminacja metanolu z amoniakiem:
Proces ten prowadzony jest w obecności katalizatora glinowo-krzemianowego w wysokiej temperaturze (ok. 400°C) i pod ciśnieniem. W zależności od warunków można uzyskać:- metyloaminę (CH₃NH₂),
- dimetyloaminę ((CH₃)₂NH),
- trimetyloaminę ((CH₃)₃N).
CH₃OH + NH₃ → CH₃NH₂ + H₂O - Reakcja formaldehydu z amoniakiem:
Alternatywna metoda otrzymywania metyloaminy polega na kondensacji formaldehydu z amoniakiem i redukcji powstałego iminy. Proces ten może prowadzić do mieszaniny amin, ale pozwala uzyskać czystą metyloaminę przy odpowiedniej kontroli parametrów. - Redukcja nitrozwiązków:
W warunkach laboratoryjnych metyloaminę można także otrzymać przez redukcję nitrometanu, jednak ze względu na koszty i toksyczność odczynników, metoda ta ma znaczenie głównie akademickie.
Wszystkie te procesy prowadzą do uzyskania metyloaminy w postaci gazu technicznego lub wodnego roztworu (zwykle 30–40%), który łatwiej przechowywać i transportować.
Metyloamina, dzięki swojej prostej budowie, silnym właściwościom zasadowym i łatwej dostępności, stała się związkiem bazowym w chemii przemysłowej i organicznej. W kolejnej części przyjrzymy się jej właściwościom fizykochemicznym oraz reaktywności chemicznej, które czynią ją tak użyteczną w syntezie organicznej, analizie chemicznej i wielu dziedzinach przemysłu.
Właściwości fizykochemiczne i chemiczne metyloaminy
Zapach, stan skupienia, polarność i temperatura wrzenia
Metyloamina (CH₃NH₂) w warunkach normalnych występuje jako bezbarwny gaz o silnym, charakterystycznym zapachu, przypominającym zapach amoniaku zmieszany z rybim aromatem. Już przy bardzo niskim stężeniu w powietrzu (poniżej 1 ppm) zapach jest wyczuwalny, co sprawia, że obecność metyloaminy można łatwo wykryć bez specjalistycznych przyrządów.
Jako związek o niskiej masie molowej, metyloamina ma bardzo niską temperaturę wrzenia, wynoszącą ok. -6°C, co oznacza, że w temperaturze pokojowej pozostaje w stanie gazowym. Jednak bardzo dobrze rozpuszcza się w wodzie, tworząc roztwory o zasadowym odczynie. Ta rozpuszczalność wynika z obecności wolnej pary elektronowej na atomie azotu, która może tworzyć wiązania wodorowe z cząsteczkami wody.
Metyloamina ma też właściwości silnie higroskopijne, co oznacza, że z łatwością chłonie wilgoć z otoczenia. Z tego względu przechowywana jest często jako roztwór wodny, co ułatwia bezpieczne obchodzenie się z tym związkiem w laboratoriach i zakładach produkcyjnych.
Cząsteczka metyloaminy jest mocno spolaryzowana, co sprawia, że:
- dobrze rozpuszcza się nie tylko w wodzie, ale także w alkoholach, eterze etylowym i acetonie,
- jej właściwości zasadowe są wyraźnie zaznaczone – silniejsze niż w przypadku amoniaku.
Reaktywność – zasadowość, tworzenie soli, reakcje z kwasami i aldehydami
Pod względem chemicznym metyloamina wykazuje zachowanie typowe dla zasad organicznych. Jej zasadowość wynika z obecności wolnej pary elektronowej na atomie azotu, która umożliwia przyłączanie protonu i tworzenie jonu metyloamoniowego (CH₃NH₃⁺):
CH₃NH₂ + H⁺ → CH₃NH₃⁺
Dzięki temu metyloamina reaguje z wieloma kwasami nieorganicznymi i organicznymi, tworząc sole aminowe. Przykładami są:
- z kwasem solnym:
CH₃NH₂ + HCl → CH₃NH₃Cl (chlorek metyloamoniowy) - z kwasem azotowym:
CH₃NH₂ + HNO₃ → CH₃NH₃NO₃ (azotan metyloamoniowy)
Te sole są zazwyczaj dobrze rozpuszczalne w wodzie i mają znaczenie przemysłowe – niektóre wykazują właściwości wybuchowe, dlatego stosuje się je ostrożnie w produkcji materiałów inicjujących i wybuchowych.
Metyloamina reaguje także z aldehydami i ketonami, tworząc zasady Schiffa (iminę). Proces ten wykorzystywany jest m.in. w:
- syntezie związków farmaceutycznych,
- preparatyce ligandów organicznych,
- modyfikacji materiałów i biocząsteczek.
Przykład reakcji z formaldehydem:
CH₃NH₂ + HCHO → CH₃N=CH₂ + H₂O
Reaktywność metyloaminy z grupami karbonylowymi umożliwia też tworzenie pochodnych karbaminianowych, amidowych i uretanowych, co czyni ją wszechstronnym prekursorem w syntezie organicznej.
Metyloamina wykazuje również:
- zdolność do alkilacji i acyloacji,
- udział w reakcjach kondensacji (np. Mannicha),
- aktywność wobec związków elektrofilowych, np. chlorków kwasowych, halogenków alkilowych.
Dzięki temu służy jako blok konstrukcyjny dla bardziej złożonych struktur organicznych – leków, pestycydów, dodatków do paliw i polimerów.
Wpływ na zdrowie, bezpieczeństwo i przechowywanie
Choć metyloamina jest stosunkowo prostym związkiem, jej właściwości fizykochemiczne sprawiają, że należy do substancji niebezpiecznych i wymaga przestrzegania odpowiednich zasad BHP. Jest to związek:
- łatwopalny – jego pary mogą tworzyć mieszaniny wybuchowe z powietrzem,
- toksyczny przy wdychaniu – działa drażniąco na drogi oddechowe, oczy i błony śluzowe,
- szkodliwy przy kontakcie ze skórą i oczami – może powodować zaczerwienienia, pieczenie, oparzenia chemiczne.
Długotrwała ekspozycja na metyloaminę może prowadzić do:
- zaburzeń neurologicznych,
- uszkodzeń wątroby i nerek,
- reakcji uczuleniowych i astmatycznych.
W związku z tym, podczas pracy z metyloaminą należy stosować:
- wentylację miejscową i ogólną,
- rękawice nitrylowe, okulary ochronne i fartuchy laboratoryjne,
- detektory obecności gazów, jeśli pracuje się z formą gazową pod ciśnieniem.
Przechowywanie metyloaminy wymaga użycia:
- szczelnych butli ciśnieniowych (dla gazu),
- pojemników z ciemnego szkła lub stali kwasoodpornej (dla roztworów),
- chłodnych, suchych i dobrze wentylowanych pomieszczeń, z dala od źródeł zapłonu i utleniaczy.
Metyloamina objęta jest także przepisami dotyczącymi prekursora narkotyków, ponieważ może być wykorzystywana do syntezy nielegalnych substancji – w związku z tym jej zakup i obrót podlegają regulacjom prawnym w wielu krajach.
Dzięki swojej zasadowości, reaktywności i zdolności do tworzenia stabilnych pochodnych metyloamina odgrywa istotną rolę w chemii organicznej i przemysłowej. W kolejnej części przyjrzymy się, jak wykorzystuje się ją w produkcji leków, agrochemikaliów, materiałów chemicznych i w badaniach laboratoryjnych.
Zastosowanie metyloaminy w przemyśle i laboratoriach
Produkcja leków, pestycydów, barwników i środków powierzchniowo czynnych
Metyloamina jest niezwykle ceniona w przemyśle chemicznym jako substrat w syntezach organicznych. Ze względu na swoją prostą budowę, reaktywność i zasadowość, znajduje zastosowanie jako podstawowy budulec cząsteczek o złożonej strukturze biologicznej i technologicznej. W przemyśle farmaceutycznym metyloamina wykorzystywana jest do syntezy:
- leków przeciwhistaminowych (np. difenhydraminy),
- leków przeciwdepresyjnych,
- leków przeciwnowotworowych (np. mekloretamina – cytostatyk z grupy związków azotowych),
- leków przeciwbakteryjnych,
- związków psychoaktywnych – choć nielegalne wykorzystania również istnieją i podlegają kontroli.
W agrochemii metyloamina służy jako prekursor do:
- insektycydów,
- fungicydów,
- regulatorów wzrostu roślin,
- związków biobójczych używanych do ochrony magazynowanych produktów rolnych.
Stosuje się ją również do produkcji barwników przemysłowych, w tym barwników do tkanin i tuszów drukarskich, gdzie pełni rolę:
- składnika nośnika,
- modyfikatora struktury molekularnej,
- reagentu wiążącego grupy funkcyjne odpowiedzialne za trwałość barwy.
W przemyśle kosmetycznym i detergentowym metyloamina wykorzystywana jest pośrednio w syntezie środków powierzchniowo czynnych, czyli związków, które obniżają napięcie powierzchniowe między cieczą a gazem lub inną cieczą. Znajdują się one w składzie:
- szamponów i mydeł,
- emulgatorów kosmetycznych,
- pianek do golenia i past do zębów,
- środków czyszczących i dezynfekujących.
Znaczenie w syntezie chemicznej i farmaceutycznej
W chemii organicznej metyloamina jest uważana za jeden z najważniejszych surowców do budowy układów aminowych i heterocyklicznych. Służy jako:
- nukleofil w reakcjach substytucji i kondensacji,
- reagent w tworzeniu amidów, uretanów, karbaminianów,
- związek tworzący zasady Schiffa (iminy),
- prekursor związków chelatujących metale, stosowanych w analizie i medycynie.
Jako źródło grupy aminowej, metyloamina uczestniczy w:
- reakcjach Mannicha,
- syntezie aminokwasów,
- konstrukcji szkieletów alkaloidowych,
- tworzeniu strukturalnych analogów neuroprzekaźników, co ma znaczenie w projektowaniu leków działających na układ nerwowy.
W przemyśle polimerowym wykorzystywana jest do produkcji żywic epoksydowych, poliamidowych i uretanowych, gdzie może pełnić rolę:
- katalizatora reakcji,
- modyfikatora lepkości,
- łańcucha zakończonego grupą aminową dla dalszych modyfikacji.
Zastosowanie metyloaminy w syntezie związków bioaktywnych oraz materiałów o specjalistycznym przeznaczeniu (np. membran, jonitów, nanokompozytów) sprawia, że jest nieodłącznym elementem nowoczesnych technologii chemicznych.
Przykłady zastosowań w analizie chemicznej i materiałoznawstwie
W laboratoriach badawczych i analitycznych metyloamina znajduje zastosowanie jako:
- czynnik reakcyjny w analizie strukturalnej związków organicznych,
- reagent do modyfikacji powierzchni materiałów stałych, np. funkcjonalizacji nanorurek węglowych,
- substancja modelowa w badaniach spektroskopowych (IR, NMR, UV).
Może być również wykorzystywana do:
- testów jakościowych na obecność grup karbonylowych – przez tworzenie zasad Schiffa,
- preparatyki buforów zasadowych o niskiej mocy,
- analizy chemii gazów – dzięki swojej reaktywności i detekowalności (łatwy zapach i widoczność w chromatografii).
W materiałoznawstwie metyloamina służy jako reagent w tworzeniu:
- polimerów przewodzących i elektroaktywnych,
- półprzewodnikowych warstw organicznych,
- struktur porowatych w materiałach MOF i COF, które znajdują zastosowanie w magazynowaniu gazów, katalizie i filtracji molekularnej.
Coraz częściej wykorzystuje się ją też w:
- technologiach recyklingu chemicznego,
- oczyszczaniu spalin i emisji przemysłowych,
- syntezie zielonych chemikaliów jako substancję startową w bardziej zrównoważonych procesach produkcji.
Metyloamina to nie tylko prosta amina alifatyczna – to związek o ogromnym potencjale syntetycznym, analitycznym i przemysłowym, będący fundamentem dla dziesiątek procesów chemicznych o znaczeniu gospodarczym i naukowym. Bez niej trudno sobie wyobrazić nowoczesną farmację, inżynierię materiałową, a nawet przemysł spożywczy czy elektroniczny.
FAQ metyloamina – najczęstsze pytania i odpowiedzi
Jaki jest wzór chemiczny metyloaminy?
Wzór chemiczny metyloaminy to CH₃NH₂ – jest to amina pierwszorzędowa, pochodna amoniaku, w której jeden atom wodoru zastąpiono grupą metylową.
Jakie właściwości ma metyloamina?
Metyloamina to bezbarwny, łatwopalny gaz o silnym zapachu amoniaku. Dobrze rozpuszcza się w wodzie i działa zasadowo.
Jak otrzymuje się metyloaminę?
Otrzymuje się ją przez aminację metanolu lub reakcję formaldehydu z amoniakiem, zwykle w obecności katalizatora.
Do czego wykorzystuje się metyloaminę?
Metyloamina jest stosowana do produkcji leków, pestycydów, barwników, żywic, środków czyszczących i w syntezach chemicznych.
Czy metyloamina jest niebezpieczna?
Tak, metyloamina może działać drażniąco na oczy i drogi oddechowe, jest łatwopalna i toksyczna – wymaga odpowiedniego przechowywania i środków ochrony.
- Jak wybrać idealny sweter męski rozpinany? 4 wskazówki - 1 października, 2025
- BREEAM – praktyczny przewodnik po certyfikacji zrównoważonych budynków - 24 września, 2025
- Laptopy Dell Latitude – technologia dla biznesu i profesjonalistów - 18 września, 2025



Opublikuj komentarz