CaCO₃ – właściwości, zastosowanie i znaczenie w przemyśle i przyrodzie
Właściwości chemiczne i fizyczne CaCO₃
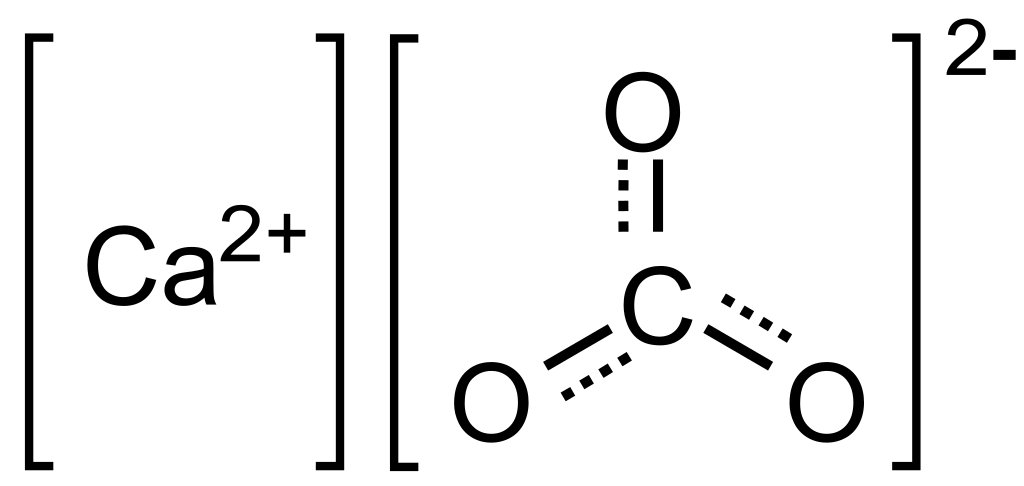
Wzór i budowa węglanu wapnia
CaCO₃, czyli węglan wapnia, to jeden z najbardziej rozpowszechnionych związków nieorganicznych na Ziemi, występujący w skorupie ziemskiej, organizmach żywych oraz licznych produktach przemysłowych. Jego wzór chemiczny odzwierciedla obecność jonu wapniowego Ca²⁺ i grupy anionowej CO₃²⁻, połączonych w stosunku 1:1 w strukturze jonowej.
W naturze CaCO₃ występuje głównie w trzech odmianach krystalicznych:
- Kalcyt – najbardziej stabilna forma termodynamicznie, mająca układ trygonalny,
- Aragonit – forma metastabilna, krystalizująca w układzie rombowym, występująca m.in. w perłach i szkieletach koralowców,
- Waterkit – rzadsza forma krystaliczna o strukturze ortorombicznej.
Odmiany te mają taką samą masę molową (100,09 g/mol), ale różnią się gęstością, twardością i strukturą wewnętrzną, co wpływa na ich zachowanie w różnych warunkach fizykochemicznych.
Dzięki dużej zmienności form i powszechnemu występowaniu, CaCO₃ jest kluczowym związkiem dla geologii, paleontologii, biologii morza i wielu gałęzi przemysłu, a jego właściwości fizyczne i chemiczne mają istotne znaczenie dla licznych procesów naturalnych i technologicznych.
Formy występowania: kalcyt, aragonit, kreda, marmur
W naturze węglan wapnia występuje zarówno jako składnik skał osadowych, jak i produkt działalności organizmów żywych. Do najczęściej spotykanych form należą:
- Wapień – skała osadowa złożona głównie z kalcytu, wykorzystywana w budownictwie i przemyśle cementowym.
- Kreda – drobnoziarnista odmiana wapienia, powstała z nagromadzenia mikroskopijnych szczątków planktonu, wyjątkowo miękka i porowata.
- Marmur – skała metamorficzna, powstała z przeobrażenia wapieni lub dolomitów pod wpływem wysokiego ciśnienia i temperatury. Charakteryzuje się wysoką twardością i walorami estetycznymi.
- Skorupy i szkieletowe struktury organizmów morskich – muszle małży, ślimaków, ramienionogów, korale, plankton wapienny, które zawierają głównie aragonit.
Formy biogeniczne CaCO₃ (czyli pochodzenia biologicznego) odgrywają istotną rolę w cyklu węglowym – organizmy pobierają węgiel nieorganiczny z wody morskiej, tworząc struktury szkieletowe, które po ich śmierci ulegają osadzaniu i lithifikacji, tworząc warstwy skał wapiennych.
W postaci czystej, CaCO₃ to biały proszek o ziarnistej lub krystalicznej strukturze, bez zapachu i smaku. Jest nierozpuszczalny w wodzie, choć jego rozpuszczalność zwiększa się w obecności dwutlenku węgla (CO₂), co prowadzi do powstania dwuwęglanu wapnia Ca(HCO₃)₂ – zjawisko to ma kluczowe znaczenie dla procesów krasowych i tworzenia jaskiń wapiennych.
Rozpuszczalność, reakcje chemiczne, zachowanie w środowisku kwaśnym
Jedną z najważniejszych właściwości chemicznych CaCO₃ jest jego niewielka rozpuszczalność w czystej wodzie – wynosi około 0,0013 g/100 ml wody w temperaturze 25°C. Jednak w obecności dwutlenku węgla (CO₂) rozpuszczalność znacznie wzrasta, ponieważ zachodzi reakcja:
CaCO₃ + CO₂ + H₂O → Ca(HCO₃)₂
W ten sposób powstaje dwuwęglan wapnia, który jest dobrze rozpuszczalny i odpowiedzialny za zjawiska twardości wody oraz za erozję skał wapiennych. To właśnie ta reakcja odpowiada za tworzenie słynnych form krasowych, takich jak jaskinie, leje krasowe i stalaktyty.
Węglan wapnia reaguje również z kwasami, np. z kwasem solnym, według równania:
CaCO₃ + 2HCl → CaCl₂ + CO₂↑ + H₂O
Jest to reakcja typowa dla związków o charakterze zasadowym – w obecności kwasu CaCO₃ neutralizuje go, wydzielając pęcherzyki dwutlenku węgla, co stanowi prosty test laboratoryjny na obecność węglanów. Dzięki tej właściwości, CaCO₃ jest wykorzystywany jako substancja zobojętniająca, zarówno w chemii, jak i w medycynie.
Pod wpływem podgrzewania węglan wapnia ulega reakcji rozkładu termicznego (kalcynacji):
CaCO₃ → CaO + CO₂↑
Proces ten zachodzi w temperaturze powyżej 825°C i prowadzi do powstania tlenku wapnia (wapna palonego) oraz wydzielenia dwutlenku węgla. Ta reakcja jest podstawą produkcji wapna w przemyśle budowlanym i chemicznym.
Węglan wapnia jest stosunkowo odporny na działanie czynników atmosferycznych, ale w środowisku kwaśnym (np. w wyniku kwaśnych deszczy lub obecności zanieczyszczeń przemysłowych) ulega rozpuszczeniu i erozji, co prowadzi do degradacji elewacji, posągów i zabytków wykonanych z marmuru lub wapienia.
W środowisku naturalnym CaCO₃ pełni funkcję bufora – stabilizuje pH wód powierzchniowych, jezior i oceanów, przeciwdziałając ich zakwaszeniu. Jego obecność w glebie wpływa korzystnie na strukturę i odczyn podłoża, ułatwiając wzrost roślin, szczególnie tych wrażliwych na kwaśność.
Dzięki swoim właściwościom węglan wapnia jest materiałem wielofunkcyjnym i nieodzownym w wielu dziedzinach życia – od geologii po przemysł, od ochrony środowiska po farmację. Jego neutralność chemiczna, dostępność i stabilność sprawiają, że jest nie tylko najczęściej występującym minerałem w skorupie ziemskiej, ale również jednym z najczęściej wykorzystywanych w codziennej praktyce związków chemicznych.
Zastosowanie węglanu wapnia w różnych gałęziach przemysłu
Budownictwo, przemysł cementowy i szklarski
Węglan wapnia (CaCO₃) jest niezwykle istotnym surowcem w budownictwie, gdzie wykorzystywany jest zarówno w postaci skał wapiennych i marmuru, jak i przetworzonego proszku o wysokiej czystości chemicznej. W budownictwie drogim i kubaturowym stosuje się go w formie:
- kruszywa wapiennego,
- materiału konstrukcyjnego,
- dodatku do zapraw murarskich i tynków,
- wypełniacza w płytach gipsowo-kartonowych,
- komponentu dekoracyjnego w postaci kamienia elewacyjnego, posadzek, parapetów czy schodów marmurowych.
W przemyśle cementowym CaCO₃ jest kluczowym składnikiem do produkcji klinkieru portlandzkiego. Proces ten opiera się na kalcynacji wapienia, czyli jego rozkładzie termicznym:
CaCO₃ → CaO + CO₂↑
Powstały tlenek wapnia wchodzi następnie w reakcję z krzemianami i glinianami, tworząc struktury odpowiedzialne za twardnienie cementu. Bez obecności węglanu wapnia nie byłoby możliwe wytwarzanie najpopularniejszych typów cementu, co czyni ten związek fundamentem współczesnego budownictwa.
W przemyśle szklarskim CaCO₃ wykorzystywany jest jako topnik – obniża temperaturę topnienia mieszaniny surowców i wpływa na klarowność oraz stabilność chemiczną gotowego szkła. Razem z piaskiem kwarcowym i węglanem sodu tworzy podstawową mieszankę do produkcji szkła sodowo-wapniowego, które znajduje zastosowanie w produkcji szyb, opakowań i wyrobów gospodarstwa domowego.
Rolnictwo, farmacja, przemysł spożywczy i chemiczny
W rolnictwie CaCO₃ pełni funkcję środka odkwaszającego glebę. Gleby o zbyt niskim pH utrudniają przyswajanie składników pokarmowych i wpływają negatywnie na wzrost roślin. Wapnowanie gleby przy użyciu węglanu wapnia pozwala na:
- podniesienie pH gleby,
- poprawę struktury i aktywności biologicznej gleby,
- zwiększenie dostępności mikroelementów,
- zmniejszenie toksyczności jonów glinu i manganu.
Stosuje się go w formie wapna nawozowego, kredy rolniczej lub dolomitu. Wysoka reaktywność w środowisku kwaśnym sprawia, że jest bardzo efektywny, a jednocześnie bezpieczny dla życia mikroorganizmów glebowych.
W farmacji i przemyśle spożywczym CaCO₃ ma zastosowanie jako:
- suplement wapnia – stosowany w leczeniu osteoporozy, demineralizacji kości, wspomagająco w okresie wzrostu lub ciąży,
- lek zobojętniający kwas żołądkowy – naturalny neutralizator kwasu solnego w leczeniu zgagi i niestrawności,
- dodatek do past do zębów – jako łagodny środek ścierający i remineralizujący szkliwo,
- substancja przeciwzbrylająca i barwnik spożywczy (E170) – występuje np. w gumach do żucia, wypiekach, wyrobach cukierniczych.
W przemyśle chemicznym węglan wapnia służy jako baza do produkcji związków wapnia, takich jak:
- chlorek wapnia (CaCl₂) – stosowany do odladzania, osuszania i stabilizacji nawierzchni drogowych,
- tlenek wapnia (CaO) – szeroko stosowany w hutnictwie, ceramice, produkcji farb i papieru,
- wodorotlenek wapnia (Ca(OH)₂) – składnik zapraw budowlanych, środek odkażający, składnik nawozów.
Wypełniacz i środek modyfikujący w tworzywach, farbach i papierze
Jednym z najważniejszych przemysłowych zastosowań CaCO₃ jest jego rola jako wypełniacza – materiału dodawanego do różnych produktów w celu nadania im odpowiednich właściwości fizycznych, obniżenia kosztów produkcji i poprawy funkcjonalności. Węglan wapnia stosuje się jako:
- wypełniacz w papierze – poprawia białość, zwiększa sztywność i nieprzezroczystość, umożliwia produkcję papieru kredowanego,
- składnik tworzyw sztucznych (PVC, polietylen, polipropylen) – wpływa na poprawę właściwości mechanicznych, termicznych i zwiększenie odporności na promieniowanie UV,
- dodatek do farb i lakierów – pełni funkcję taniego pigmentu oraz zagęstnika i matującego czynnika,
- komponent gumy i elastomerów – poprawia właściwości fizyczne produktów końcowych.
W postaci mikronizowanej lub jako CaCO₃ o wysokiej czystości (PCC – Precipitated Calcium Carbonate) związek ten ma bardzo szerokie zastosowanie w przemyśle kosmetycznym, lakierniczym, tekstylnym i elektronicznym. Precyzyjne dopasowanie cząstek do potrzeb aplikacyjnych umożliwia osiąganie wyjątkowej jakości wyrobów końcowych.
Wysoka dostępność, niska cena i nietoksyczność CaCO₃ sprawiają, że jest to jeden z najbardziej uniwersalnych surowców pomocniczych w przemyśle. Jednocześnie jego naturalne pochodzenie i możliwość odzysku czynią go materiałem atrakcyjnym z punktu widzenia ekologii i zrównoważonego rozwoju. W dzisiejszych czasach, gdy rośnie znaczenie gospodarki cyrkularnej, węglan wapnia coraz częściej jest postrzegany jako zasób strategiczny o dużym potencjale zastosowań przyszłościowych – od biodegradowalnych opakowań po materiały budowlane nowej generacji.

Rola CaCO₃ w przyrodzie i środowisku
Składnik skał osadowych i struktur organizmów morskich
Węglan wapnia (CaCO₃) odgrywa niezwykle istotną rolę w geologii oraz biologii mórz i oceanów. Jest podstawowym składnikiem wielu skał osadowych, takich jak wapienie, margle, kreda i dolomity (w przypadku domieszek MgCO₃). Powstaje w procesie sedymentacji szczątków organizmów morskich, które po śmierci opadają na dno zbiorników wodnych i ulegają lithifikacji.
W środowisku morskim CaCO₃ tworzy szkielety i muszle licznych organizmów, takich jak:
- koralowce – budujące rafy koralowe z aragonitu,
- skorupiaki i małże – tworzące muszle bogate w kalcyt i aragonit,
- plankton wapienny (np. kokolitofory) – których mikroskopijne płytki wapienne stanowią ogromną część osadów oceanicznych.
Te biologiczne formy CaCO₃ są nie tylko elementem strukturalnym, ale także archiwum środowiskowych zmian klimatycznych, ponieważ ich skład izotopowy i mineralny zależy od temperatury i składu chemicznego wód, w których powstały. Analiza skał wapiennych i skamieniałości pozwala rekonstruować klimat sprzed milionów lat, odtwarzać poziom mórz, zasolenie i obieg węgla.
Znaczenie w procesie obiegu węgla i regulacji pH wód
Węglan wapnia pełni centralną rolę w globalnym obiegu węgla, który obejmuje atmosferę, hydrosferę, litosferę i biosferę. Procesy, w których uczestniczy CaCO₃, wpływają bezpośrednio na stężenie dwutlenku węgla (CO₂) w atmosferze oraz buforowanie pH oceanów. Do kluczowych reakcji należy:
CaCO₃ + CO₂ + H₂O ⇌ Ca²⁺ + 2HCO₃⁻
Ta równowaga chemiczna sprawia, że oceany są zdolne do pochłaniania ogromnych ilości CO₂, a jednocześnie stabilizują pH wody morskiej na poziomie korzystnym dla życia morskiego (ok. 8,1). Gdy w wodzie jest za dużo CO₂ (np. w wyniku działalności człowieka), równowaga przesuwa się w prawo, co skutkuje:
- rozpuszczaniem muszli i szkieletów organizmów,
- obniżeniem nasycenia aragonitem i kalcytem,
- zakwaszaniem oceanów, które zagraża koralowcom i planktonowi.
Dzięki swojej obecności w wodach gruntowych i powierzchniowych, CaCO₃ pełni również funkcję naturalnego bufora zasadowego, który przeciwdziała nadmiernym wahaniom pH wywołanym przez kwaśne deszcze, działalność rolniczą lub zanieczyszczenia przemysłowe. Jest to szczególnie ważne w jeziorach i rzekach o niskiej mineralizacji, gdzie nawet niewielka zmiana pH może zaburzyć równowagę ekosystemu.
Reakcje zachodzące w glebie i wpływ na wzrost roślin
W glebie węglan wapnia odgrywa kluczową rolę w utrzymaniu odpowiedniego odczynu pH, struktury gleby oraz dostępności składników odżywczych. Gleby zasobne w CaCO₃ są:
- lepiej napowietrzone i przepuszczalne,
- bogatsze w mikroorganizmy glebowe,
- bardziej odporne na zakwaszenie,
- wydajniejsze pod względem przyswajalności azotu, fosforu i potasu przez rośliny.
Zbyt kwaśne gleby ograniczają rozwój roślin, osłabiają strukturę korzeni i powodują wypłukiwanie wapnia, magnezu i molibdenu, a jednocześnie zwiększają toksyczność glinu i manganu. Dodatek węglanu wapnia w formie kredy rolniczej czy wapna nawozowego neutralizuje nadmiar jonów H⁺, podnosząc pH i poprawiając warunki do rozwoju roślin.
W procesie próchnicyzacji oraz mineralizacji materii organicznej, CaCO₃ stabilizuje powstające kwasy organiczne i przeciwdziała tworzeniu nieprzyswajalnych kompleksów metali ciężkich. Ponadto wspiera rozwój bakterii azotowych (np. z rodzaju Nitrosomonas i Nitrobacter), które są niezbędne dla cyklu azotowego w glebie.
W rolnictwie ekologicznym i regeneratywnym CaCO₃ jest traktowany jako naturalny regulator gleby, który nie tylko wspomaga wzrost roślin, ale również przyczynia się do odbudowy aktywności mikrobiologicznej i bioróżnorodności podłoża. W połączeniu z innymi składnikami organicznymi (np. kompostem, biohumusem) tworzy zrównoważone środowisko glebowe, sprzyjające produkcji zdrowej i pełnowartościowej żywności.
Węglan wapnia jest więc nie tylko minerałem o szerokim zastosowaniu przemysłowym, ale także istotnym czynnikiem geochemicznym i biologicznym, bez którego wiele procesów naturalnych – od powstawania gleby, przez cykl węgla, po budowę raf koralowych – nie mogłoby przebiegać w sposób zrównoważony. Jego obecność w przyrodzie jest przejawem harmonii między światem mineralnym a biologicznym, a rola w ochronie środowiska i produkcji żywności tylko podkreśla jego uniwersalną wartość.
FAQ CaCO₃ – zastosowania i właściwości węglanu wapnia
Co to jest CaCO₃?
CaCO₃ to wzór chemiczny węglanu wapnia – nieorganicznego związku powszechnie występującego w naturze, m.in. w kredzie, wapieniu i marmurze.
Gdzie występuje węglan wapnia w przyrodzie?
Węglan wapnia występuje w skałach osadowych, skorupkach muszli, koralowcach i jako główny składnik wielu minerałów, takich jak kalcyt i aragonit.
Jakie są zastosowania CaCO₃?
Węglan wapnia wykorzystywany jest w budownictwie, rolnictwie, farmacji, produkcji papieru, plastiku, farb, kosmetyków oraz jako dodatek spożywczy i lek zobojętniający kwas żołądkowy.
Czy CaCO₃ rozpuszcza się w wodzie?
Węglan wapnia ma bardzo niską rozpuszczalność w czystej wodzie, ale łatwo reaguje z kwasami, rozpuszczając się z wydzieleniem dwutlenku węgla.
Czy CaCO₃ jest bezpieczny?
Tak, CaCO₃ jest generalnie uważany za bezpieczny – jest stosowany jako suplement wapnia i lek neutralizujący nadkwasotę, choć w dużych ilościach może powodować zaparcia.
- Lamele ścienne – praktyczny i estetyczny materiał do nowoczesnych aranżacji wnętrz - 30 października, 2025
- Jak wybrać idealny sweter męski rozpinany? 4 wskazówki - 1 października, 2025
- BREEAM – praktyczny przewodnik po certyfikacji zrównoważonych budynków - 24 września, 2025




Opublikuj komentarz