Anilina – właściwości, zastosowania i wpływ na zdrowie człowieka
Czym jest anilina i jakie ma właściwości?
Budowa chemiczna i podstawowe cechy fizykochemiczne
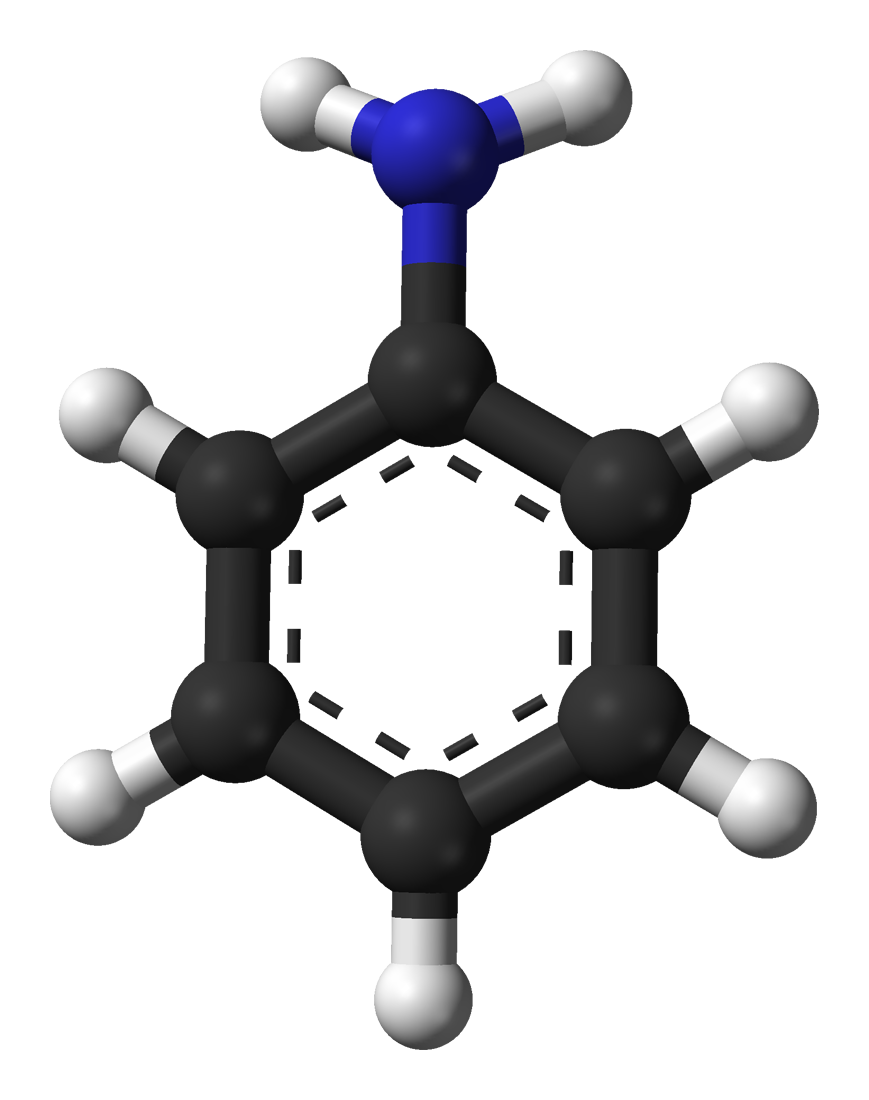
Anilina to organiczny związek chemiczny należący do grupy amin aromatycznych. Jej wzór chemiczny to C₆H₅NH₂, co oznacza, że jest to pochodna benzenu, w której jeden z atomów wodoru został zastąpiony przez grupę aminową (-NH₂). Ta stosunkowo niewielka zmiana strukturalna nadaje anilinie całkiem inne właściwości niż sam benzen – zarówno chemiczne, jak i toksykologiczne.
W warunkach standardowych anilina jest bezbarwną lub lekko żółtawą, oleistą cieczą o charakterystycznym, nieprzyjemnym zapachu, przypominającym zapach ryb lub zgniłych owoców. Jej temperatura topnienia wynosi około -6°C, a temperatura wrzenia to 184°C. Anilina jest słabo rozpuszczalna w wodzie, ale bardzo dobrze rozpuszcza się w wielu rozpuszczalnikach organicznych, takich jak alkohol, eter dietylowy czy aceton.
Jedną z cech charakterystycznych aniliny jest jej reaktywność chemiczna – obecność grupy aminowej przy pierścieniu aromatycznym sprawia, że związek ten łatwo wchodzi w reakcje elektrofilowe podstawienia, acylacji, diazotacji czy nitrowania. W temperaturze pokojowej ulega utlenianiu pod wpływem światła i powietrza, co prowadzi do jej zabarwienia – czysta anilina jest bezbarwna, ale z czasem przybiera barwę brunatną lub czerwonawą.
Warto zaznaczyć, że anilina jest związkiem zasadowym – grupa aminowa może przyjmować proton, tworząc sole z kwasami, np. chlorowodorek aniliny. Ta właściwość ma ogromne znaczenie w technologii przemysłowej, szczególnie podczas reakcji prowadzonych w środowisku kwaśnym lub zasadowym.
Ze względu na swoje właściwości, anilina jest związkiem wszechstronnym, a jednocześnie niebezpiecznym, co wymaga odpowiedniego obchodzenia się z nią zarówno w laboratoriach, jak i w przemyśle.
Sposoby otrzymywania aniliny w laboratorium i przemyśle
Otrzymywanie aniliny można przeprowadzić na kilka sposobów, jednak najczęściej stosowaną metodą – zarówno w laboratoriach, jak i w skali przemysłowej – jest redukcja nitrobenzenu. Nitrobenzen (C₆H₅NO₂), otrzymywany w wyniku nitrowania benzenu stężonym kwasem azotowym i siarkowym, poddaje się następnie redukcji, uzyskując anilinę i wodę jako produkt uboczny.
W warunkach laboratoryjnych redukcję nitrobenzenu przeprowadza się najczęściej za pomocą cyny i kwasu solnego, żelaza i kwasu octowego, bądź z użyciem bardziej nowoczesnych reduktorów, takich jak borowodorki lub katalizatory wodorowe. Reakcja jest egzotermiczna i wymaga kontrolowania temperatury oraz odpowiedniego pH.
W skali przemysłowej najczęściej stosowaną metodą jest redukcja katalityczna wodorem w obecności katalizatora, najczęściej niklowego lub miedziano-chromowego. Proces ten odbywa się pod wysokim ciśnieniem i w podwyższonej temperaturze, co zapewnia wysoką wydajność i czystość produktu końcowego. Anilina powstała w ten sposób trafia bezpośrednio do dalszej syntezy przemysłowej lub jest oczyszczana i destylowana.
Inną, rzadziej wykorzystywaną metodą otrzymywania aniliny jest aminacja halogenobenzenów – polega ona na podstawieniu atomu halogenu przez grupę aminową, zazwyczaj przy użyciu amoniaku i katalizatora miedzianego. Proces ten jest jednak mniej wydajny i bardziej kosztowny niż redukcja nitrobenzenu, dlatego stosowany jest głównie tam, gdzie wymagane są specyficzne pochodne aniliny.
Ciekawym i rzadkim sposobem syntezy aniliny jest również hydroliza izocyjanianów – to metoda często stosowana w chemii organicznej, kiedy potrzebna jest bardzo czysta anilina lub jej pochodne w małych ilościach.
Kluczowe właściwości wpływające na jej zastosowania
Właściwości aniliny sprawiają, że znajduje ona szerokie zastosowanie w różnych gałęziach przemysłu – od produkcji barwników, przez farmację, aż po tworzywa sztuczne. Podstawową cechą decydującą o jej użyteczności jest obecność reaktywnej grupy aminowej, która łatwo wchodzi w reakcje chemiczne, dając możliwość syntezy setek pochodnych.
Anilina jest prekursorem wielu związków aromatycznych, w tym barwników azowych, leków przeciwbólowych, środków ochrony roślin oraz substancji antyutleniających. Jej struktura umożliwia tworzenie wiązania diazowego, co czyni ją niezbędnym substratem w produkcji barwników syntetycznych. Proces diazotacji aniliny i dalsze łączenie grup diazowych z fenolami lub aminami pozwala tworzyć barwniki o intensywnych kolorach, stosowane w tekstyliach, farbach i tuszach.
W przemyśle tworzyw sztucznych anilina pełni istotną rolę jako substrat do produkcji metylendiizocyjanianu (MDI) – związku niezbędnego w produkcji pianek poliuretanowych, które znajdują szerokie zastosowanie w budownictwie, meblarstwie i motoryzacji. Właśnie to zastosowanie czyni anilinę jednym z najważniejszych półproduktów w przemyśle chemicznym XXI wieku.
Kolejną istotną właściwością aniliny jest jej zdolność do tworzenia kompleksów z metalami, co wykorzystuje się m.in. w analizie chemicznej, elektrochemii i produkcji katalizatorów. W chemii organicznej anilina służy jako nukleofil w wielu reakcjach sprzęgania, podstawienia czy kondensacji.
Trzeba jednak zaznaczyć, że mimo ogromnego potencjału przemysłowego, anilina jest substancją toksyczną, łatwo przenikającą przez skórę i błony śluzowe. Już niewielkie ilości mogą powodować zaburzenia w transporcie tlenu przez hemoglobinę (tworzenie methemoglobiny), co prowadzi do niedotlenienia tkanek. Dlatego jej stosowanie musi odbywać się pod ścisłym nadzorem i w odpowiednich warunkach technicznych.
Anilina jest również związkiem, który łatwo tworzy pochodne dzięki elektrofilowemu podstawieniu pierścienia aromatycznego – może to prowadzić do tworzenia związków nitrowych, sulfonowych czy halogenowych. To czyni ją cennym związkiem dla syntez laboratoryjnych i przemysłowych, gdzie wymagana jest modyfikacja struktury pierścienia benzenowego.
Jej właściwości fizykochemiczne, takie jak gęstość (ok. 1,02 g/cm³), współczynnik załamania światła, polarność oraz rozpuszczalność w organicznych rozpuszczalnikach, sprawiają, że jest chętnie wykorzystywana jako rozpuszczalnik reakcyjny w trudnych syntezach organicznych.
Reasumując: anilina to związek o ogromnym znaczeniu technologicznym i naukowym, który łączy w sobie wysoki potencjał reakcyjny z toksycznością wymagającą ścisłej kontroli. Jako jeden z najważniejszych przedstawicieli amin aromatycznych, nadal odgrywa kluczową rolę w chemii nowoczesnej i jest podstawą rozwoju wielu nowych materiałów oraz substancji aktywnych.

Przemysłowe i technologiczne zastosowania aniliny
Produkcja barwników, leków i tworzyw sztucznych
Anilina odgrywa kluczową rolę w wielu gałęziach przemysłu chemicznego, a jej zastosowania mają ogromne znaczenie nie tylko gospodarcze, ale i społeczne. Jednym z najstarszych i najważniejszych obszarów, w których wykorzystywana jest anilina, jest produkcja barwników syntetycznych. Już w XIX wieku, dzięki odkryciu barwnika mauveiny przez Williama Henry’ego Perkina – otrzymanego właśnie z pochodnej aniliny – rozpoczęła się era przemysłu barwnikowego, która całkowicie zmieniła świat tekstyliów.
Dzięki reakcjom diazotacji i sprzęgania, anilina umożliwia syntezę barwników azowych, które są jednymi z najintensywniej wybarwiających i najczęściej używanych barwników na świecie. Są one wykorzystywane w barwieniu tkanin, skór, papieru, a także w przemyśle poligraficznym i do produkcji tuszy. Barwniki te cechują się wysoką trwałością koloru, odpornością na działanie światła i wody oraz szeroką gamą możliwych odcieni.
Oprócz przemysłu tekstylnego, anilina znajduje zastosowanie w farmacji. Jest substratem do syntezy wielu ważnych związków o działaniu farmakologicznym, m.in. paracetamolu (acetaminofenu), fenacetyny, a także innych leków przeciwbólowych, przeciwgorączkowych i przeciwzapalnych. Dzięki grupie aminowej i jej reaktywności, anilina może być modyfikowana do uzyskania pochodnych o różnym profilu działania biologicznego. Wiele środków farmaceutycznych opiera się na strukturach powstałych właśnie z aniliny.
W nowoczesnym przemyśle chemicznym anilina odgrywa również rolę w produkcji tworzyw sztucznych, szczególnie pianki poliuretanowej. Jest ona głównym prekursorem metylendiizocyjanianu (MDI), który – razem z poliolami – tworzy bazę dla poliuretanów. Te materiały są szeroko wykorzystywane w izolacjach budowlanych, materacach, tapicerce meblowej, odzieży sportowej i motoryzacji. W tym zastosowaniu kluczowa jest wysoka czystość aniliny i jej właściwości fizykochemiczne, które umożliwiają precyzyjne sterowanie reakcją tworzenia pianek.
W sektorze produkcji tworzyw sztucznych anilina może również brać udział w syntezie niektórych żywic epoksydowych, barwników do plastiku, a także jako stabilizator termiczny w niektórych rodzajach materiałów syntetycznych.
Zastosowanie aniliny w produkcji pianek poliuretanowych
Jednym z najważniejszych zastosowań przemysłowych aniliny we współczesnym świecie jest jej rola w produkcji pianek poliuretanowych. Proces ten rozpoczyna się od reakcji aniliny z formaldehydem i tlenkiem węgla, w wyniku której powstaje metylendiizocyjanian (MDI). MDI jest kluczowym składnikiem poliuretanów – materiałów, które zdobyły ogromną popularność w wielu sektorach przemysłu.
Poliuretany powstają poprzez reakcję izocyjanianów z poliolami, co pozwala na tworzenie pianek o różnej twardości, elastyczności i gęstości. Dzięki temu można je dostosować do konkretnych potrzeb – od miękkich pianek tapicerskich po sztywne płyty izolacyjne. Anilina jako substrat do produkcji MDI ma kluczowe znaczenie w tym procesie, a jakość i czystość stosowanej aniliny wpływa bezpośrednio na właściwości finalnego produktu.
Piany poliuretanowe produkowane z udziałem aniliny wykorzystywane są m.in. w:
- izolacji termicznej budynków, dzięki niskiej przewodności cieplnej,
- motoryzacji, do produkcji siedzeń, paneli drzwiowych i systemów wyciszania,
- meblarstwie, do tworzenia komfortowych poduszek i materacy,
- sprzęcie AGD, jako elementy izolacyjne w lodówkach i zamrażarkach,
- odzieży i obuwiu sportowym, gdzie zapewniają lekkość i amortyzację.
Oprócz samej produkcji MDI, anilina może być także wykorzystywana jako dodatek modyfikujący właściwości pianek, wpływając na ich twardość, elastyczność i odporność na ścieranie. Dzięki swojej strukturze chemicznej, anilina umożliwia projektowanie materiałów o bardzo precyzyjnych właściwościach użytkowych, co czyni ją nieocenionym składnikiem nowoczesnych technologii materiałowych.
Rola aniliny w przemyśle gumowym i chemii gospodarczej
W przemyśle gumowym anilina wykorzystywana jest jako substrat do syntezy procesów wulkanizacyjnych – zwłaszcza do produkcji antyutleniaczy i przyspieszaczy wulkanizacji, które poprawiają właściwości techniczne wyrobów gumowych. Te substancje opóźniają procesy starzenia się gumy, zwiększają jej odporność na działanie tlenu, ozonu, promieniowania UV oraz temperatury. Dzięki temu opony, uszczelki i inne produkty z kauczuku zachowują swoje właściwości przez dłuższy czas.
Anilina jest również stosowana do wytwarzania stabilizatorów UV, przeciwutleniaczy oraz inhibitorów polimeryzacji, które są niezbędne w wielu gałęziach przemysłu przetwórstwa tworzyw sztucznych. Jej rola w tych procesach wynika z obecności reaktywnej grupy aminowej oraz zdolności do tworzenia silnych wiązań z rodnikami tlenowymi, które odpowiadają za degradację materiałów.
W chemii gospodarczej anilina bywa wykorzystywana jako surowiec pośredni do produkcji środków czystości, środków dezynfekcyjnych oraz kompleksowych substancji zapachowych i barwiących. Choć jej toksyczność ogranicza możliwości bezpośredniego kontaktu z użytkownikiem, wiele z jej pochodnych – po odpowiedniej modyfikacji – znajduje zastosowanie w detergentach, farbach i lakierach.
Warto dodać, że niektóre pochodne aniliny są używane jako składniki pestycydów i herbicydów, co dodatkowo pokazuje, jak szeroki jest zakres jej wpływu na nowoczesną technologię i przemysł.
Anilina, choć niepozorna jako substancja oleista o nieprzyjemnym zapachu, stanowi jeden z najbardziej wszechstronnych substratów chemicznych, bez których trudno wyobrazić sobie współczesny przemysł materiałowy, farmaceutyczny czy tekstylny. To właśnie jej uniwersalność i podatność na modyfikacje sprawiają, że mimo zagrożeń zdrowotnych, pozostaje niezwykle ceniona i szeroko wykorzystywana w tysiącach procesów technologicznych na całym świecie.

Toksyczność aniliny i jej wpływ na zdrowie oraz środowisko
Mechanizmy działania toksycznego na organizm człowieka
Anilina, mimo swojej ogromnej wartości przemysłowej, jest substancją o wysokim potencjale toksycznym, która może powodować poważne zaburzenia fizjologiczne nawet przy niewielkiej ekspozycji. Toksyczność aniliny wynika przede wszystkim z jej zdolności do utleniania hemoglobiny do methemoglobiny, formy niezdolnej do przenoszenia tlenu. W efekcie dochodzi do niedotlenienia tkanek, nawet jeśli poziom tlenu we krwi jest prawidłowy – organizm nie może go skutecznie wykorzystać.
W momencie dostania się aniliny do organizmu – czy to przez skórę, drogi oddechowe, czy przewód pokarmowy – związek ten jest metabolizowany głównie w wątrobie. Procesy metaboliczne prowadzą do powstania reaktywnych metabolitów, takich jak hydroksylaniliny i fenylohydroksyloaminy, które działają silnie utleniająco. To właśnie te metabolity odpowiadają za przekształcanie hemoglobiny i powstawanie methemoglobiny.
Skutki działania aniliny zależą od dawki, czasu ekspozycji i drogi kontaktu. W przypadku ostrego zatrucia pojawiają się objawy takie jak:
- sinica (niebieskawe zabarwienie skóry, szczególnie wokół ust i paznokci),
- osłabienie i zawroty głowy,
- nudności, bóle głowy, przyspieszone bicie serca,
- w ciężkich przypadkach: utrata przytomności, drgawki, a nawet śmierć z powodu niewydolności oddechowej.
Działanie aniliny nie ogranicza się jedynie do efektów hematologicznych. Działa ona również:
- hepatotoksycznie – może prowadzić do uszkodzenia komórek wątrobowych, co objawia się wzrostem enzymów wątrobowych, a przy dłuższej ekspozycji – marskością lub martwicą,
- nefrotoksycznie – długotrwały kontakt z aniliną może uszkadzać kanaliki nerkowe,
- neurotoksycznie – pojawiają się objawy takie jak bezsenność, nadpobudliwość, a także pogorszenie pamięci i koncentracji.
Związek ten został również zakwalifikowany jako potencjalnie rakotwórczy – szczególnie jego pochodne, takie jak niektóre barwniki azowe, wykazują właściwości mutagenne i kancerogenne. IARC (Międzynarodowa Agencja Badań nad Rakiem) klasyfikuje anilinę jako substancję z grupy 3 – nieklasyfikowaną jako rakotwórcza dla ludzi, ale z wystarczającymi dowodami szkodliwości u zwierząt.
Objawy ostrego i przewlekłego zatrucia
Zatrucie aniliną może mieć charakter ostry lub przewlekły – i choć objawy mogą być różnorodne, wiele z nich pozostaje niespecyficznych, co często utrudnia diagnozę. Najbardziej charakterystycznym objawem jest sinica, która nie ustępuje mimo podawania tlenu – to znak, że we krwi dominuje methemoglobina.
W ostrym zatruciu pojawiają się:
- uczucie duszności i przyspieszony oddech,
- uczucie osłabienia, zawroty głowy, senność,
- w cięższych przypadkach: drgawki, zaburzenia rytmu serca, utrata przytomności.
W przypadkach skrajnych, szczególnie przy ekspozycji na duże ilości par lub płynnej aniliny, może dojść do zatrzymania oddechu i krążenia. W takich sytuacjach niezbędne jest natychmiastowe podanie błękitu metylenowego – odtrutki działającej jako reduktor methemoglobiny.
Zatrucia przewlekłe są bardziej podstępne i pojawiają się przy długotrwałej, niskiej ekspozycji zawodowej. Objawy obejmują:
- ciągłe uczucie zmęczenia i spadek koncentracji,
- zaburzenia pamięci, bezsenność,
- bóle głowy, suchość w ustach, lekkie stany depresyjne,
- zmiany hematologiczne, takie jak niedokrwistość hemolityczna.
Dodatkowo, przewlekłe narażenie na anilinę może powodować:
- zmiany skórne (egzemy, reakcje alergiczne),
- zaburzenia hormonalne – wpływ na gospodarkę androgenową i estrogenową,
- zwiększoną wrażliwość na światło słoneczne (fotouczulenia).
Z tych względów każda praca z aniliną musi być prowadzona w odpowiednich warunkach, a osoby mające z nią kontakt powinny być objęte regularnymi badaniami profilaktycznymi, w tym oznaczeniem poziomu methemoglobiny we krwi.
Regulacje prawne oraz środki ochrony osobistej przy pracy z aniliną
Ze względu na wysoką toksyczność, anilina jest objęta szeregiem krajowych i międzynarodowych regulacji prawnych. Substancja ta znajduje się na listach substancji niebezpiecznych REACH (UE) oraz OSHA i EPA (USA). Klasyfikowana jest jako:
- toksyczna po kontakcie ze skórą i przez drogi oddechowe,
- drażniąca dla oczu i błon śluzowych,
- substancja niebezpieczna dla środowiska wodnego.
W Unii Europejskiej obowiązują surowe limity narażenia zawodowego:
- 0,1 ppm (0,44 mg/m³) jako wartość średniodobowa,
- obowiązek stosowania środków ochrony osobistej, systemów wentylacyjnych, dygestoriów i zamkniętych układów produkcyjnych.
W Stanach Zjednoczonych, zgodnie z OSHA, dopuszczalne stężenie aniliny w miejscu pracy to 2 ppm jako średnia z 8 godzin pracy. W wielu firmach stosuje się jednak jeszcze bardziej rygorystyczne normy wewnętrzne, szczególnie w laboratoriach farmaceutycznych.
Środki ochrony osobistej przy pracy z aniliną powinny obejmować:
- rękawice nitrylowe lub neoprenowe (lateks nie daje odpowiedniej ochrony),
- gogle ochronne lub przyłbice,
- kombinezony lub fartuchy ochronne odporne na działanie substancji chemicznych,
- maski z pochłaniaczami par organicznych, a w razie dużego stężenia – aparaty oddechowe.
Obowiązkowe są także:
- detektory obecności par aniliny w powietrzu,
- regularne przeglądy instalacji wentylacyjnych,
- szkolenia BHP i procedury ewakuacyjne na wypadek rozlania lub wycieku.
Nie mniej ważne są procedury utylizacji – aniliny nie wolno wylewać do kanalizacji ani wyrzucać z odpadami komunalnymi. Musi być przekazywana do specjalistycznych punktów zbiórki odpadów niebezpiecznych, a wszelkie pojemniki muszą być szczelnie zamknięte i odpowiednio oznaczone.
W aspekcie środowiskowym anilina może zanieczyszczać wodę i glebę, powodując śmierć organizmów wodnych nawet przy bardzo niskich stężeniach. Jest słabo biodegradowalna, przez co długo utrzymuje się w środowisku, kumulując się w łańcuchu pokarmowym. Dlatego wiele krajów wprowadziło zakazy jej stosowania w produktach codziennego użytku, takich jak farby, barwniki do włosów czy detergenty.
Świadomość zagrożeń i przestrzeganie zasad bezpieczeństwa to dziś kluczowy warunek korzystania z aniliny w przemyśle i laboratoriach. To związek o ogromnym potencjale, ale tylko odpowiedzialne podejście gwarantuje, że jego zastosowania nie odbiją się negatywnie na zdrowiu człowieka ani stanie środowiska.
FAQ anilina – najczęściej zadawane pytania
Co to jest anilina?
Anilina to organiczny związek chemiczny z grupy amin aromatycznych, mający postać oleistej cieczy o charakterystycznym zapachu. Jest prekursorem wielu barwników i tworzyw sztucznych.
Jakie są główne zastosowania aniliny?
Anilina wykorzystywana jest głównie do produkcji barwników, leków, gumy oraz pianek poliuretanowych. Ma także znaczenie w syntezach chemicznych jako surowiec pośredni.
Czy anilina jest szkodliwa dla zdrowia?
Tak, anilina jest toksyczna i może powodować uszkodzenia krwi, wątroby i układu nerwowego. Działa drażniąco na skórę i drogi oddechowe, a jej długotrwałe działanie może być rakotwórcze.
Jak wygląda kontakt z aniliną w warunkach przemysłowych?
W przemyśle anilina stosowana jest w zamkniętych systemach z użyciem środków ochrony osobistej. Kontakt z nią wymaga specjalnych procedur bezpieczeństwa i odpowiednich szkoleń.
Jakie są objawy zatrucia aniliną?
Objawy zatrucia obejmują bóle głowy, senność, sinicę, duszności i zaburzenia rytmu serca. W ciężkich przypadkach może dojść do utraty przytomności i śmierci.
- Lamele ścienne – praktyczny i estetyczny materiał do nowoczesnych aranżacji wnętrz - 30 października, 2025
- Jak wybrać idealny sweter męski rozpinany? 4 wskazówki - 1 października, 2025
- BREEAM – praktyczny przewodnik po certyfikacji zrównoważonych budynków - 24 września, 2025


Opublikuj komentarz