Octan etylu – właściwości, zastosowania i znaczenie w chemii organicznej
Czym jest octan etylu i jak wygląda jego budowa chemiczna
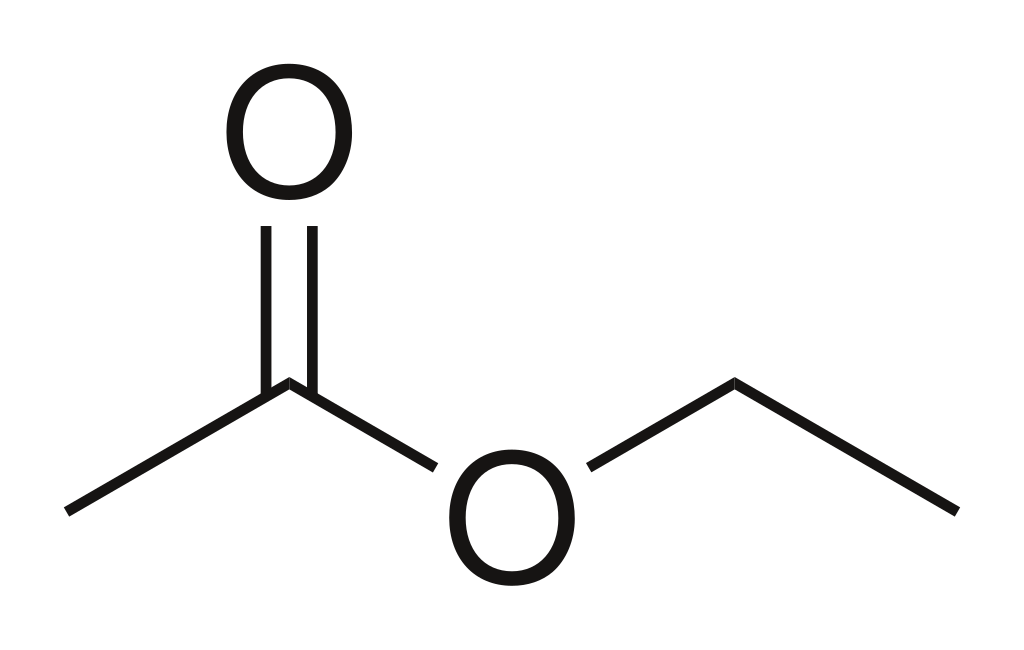
Wzór sumaryczny i strukturalny octanu etylu (CH₃COOC₂H₅)
Octan etylu, znany także jako etylowy ester kwasu octowego, to organiczny związek chemiczny należący do grupy estrów. Jego wzór sumaryczny to C₄H₈O₂, natomiast bardziej szczegółowy – CH₃COOC₂H₅ – jasno wskazuje, że cząsteczka zbudowana jest z fragmentu kwasu octowego (CH₃COOH) i fragmentu alkoholu etylowego (C₂H₅OH), połączonych poprzez wiązanie estrowe.
Struktura cząsteczki octanu etylu przedstawia się następująco:
- grupa metylowa (CH₃–) połączona z atomem węgla grupy karbonylowej (C=O),
- która z kolei połączona jest z grupą alkoksylową (–OC₂H₅), pochodzącą z etanolu.
Takie ułożenie odpowiada klasycznej strukturze estru, a sam związek należy do niskocząsteczkowych estrów kwasów karboksylowych, co nadaje mu specyficzne właściwości fizyczne i zapachowe.
Z chemicznego punktu widzenia octan etylu należy do związków o dużej wartości użytkowej – jest stosunkowo trwały, łatwo dostępny, a jednocześnie łatwo ulega reaktywności typowej dla estrów, zwłaszcza hydrolizie i reakcjom z nukleofilami.
Klasyfikacja jako ester i sposób otrzymywania (reakcja estryfikacji)
Octan etylu klasyfikowany jest jako ester kwasu karboksylowego, a dokładniej – ester kwasu octowego i etanolu. Estry powstają w wyniku kondensacji (reakcji odwodnienia) pomiędzy kwasem karboksylowym a alkoholem w obecności kwasu jako katalizatora, zwykle kwasu siarkowego(VI), który działa zarówno jako czynnik protonujący grupę karbonylową, jak i środek odwadniający.
Reakcja estryfikacji octanu etylu przebiega według ogólnego równania:
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
Warto zwrócić uwagę, że jest to reakcja równowagowa, dlatego aby uzyskać wysoką wydajność, należy:
- usuwać powstającą wodę (np. za pomocą azeotropowego destylowania lub adsorpcji),
- zastosować nadmiar jednego z reagentów (np. alkoholu),
- przeprowadzać reakcję w warunkach ogrzewania i w obecności silnego kwasu jako katalizatora.
W przemyśle reakcja ta prowadzona jest na dużą skalę w reaktorach ciągłych, a produkt końcowy poddawany jest oczyszczaniu poprzez destylację frakcyjną. Ze względu na swoją prostą budowę, reakcja ta jest także klasycznym przykładem w edukacji chemicznej – często stosowana jest w szkołach jako doświadczenie laboratoryjne ilustrujące proces estryfikacji.
Wygląd, zapach i podstawowe właściwości fizyczne
Octan etylu to bezbarwna, przezroczysta ciecz o charakterystycznym, przyjemnym zapachu, przypominającym owoce, głównie gruszki lub ananasa. Zapach ten sprawia, że jest on wykorzystywany w przemyśle perfumeryjnym i spożywczym, choć wyłącznie w odpowiednio oczyszczonej postaci, spełniającej normy dopuszczalnego kontaktu z żywnością.
Pod względem właściwości fizycznych, octan etylu:
- ma temperaturę wrzenia ok. 77°C, co oznacza, że jest stosunkowo lotny i łatwo przechodzi w stan gazowy,
- charakteryzuje się niską lepkością i gęstością – łatwo się rozprowadza i miesza z wieloma substancjami,
- ma dobrą rozpuszczalność w etanolu, acetonie, chloroformie i innych rozpuszczalnikach organicznych,
- słabo rozpuszcza się w wodzie, ale wystarczająco, by tworzyć mieszaniny homogoniczne przy określonych proporcjach (rozpuszczalność wynosi ok. 8,7 g/100 ml wody w 20°C).
Jednocześnie jego łatwopalność czyni go związkiem wymagającym ostrożnego obchodzenia się:
- tworzy łatwopalne mieszaniny par z powietrzem,
- jego opary mogą przemieszczać się po powierzchni i zapalać od odległego źródła ognia,
- punkt zapłonu wynosi ok. -4°C, co kwalifikuje go jako substancję o wysokim ryzyku zapłonu.
Pod względem toksykologicznym octan etylu jest uznawany za niskotoksyczny, jednak może powodować podrażnienia skóry, oczu i dróg oddechowych, zwłaszcza przy długotrwałym lub intensywnym narażeniu. Wdychanie dużych ilości par może prowadzić do zawrotów głowy, senności i uczucia zmęczenia.
Octan etylu jest zatem związkiem, który łączy prostą budowę chemiczną z szerokim spektrum właściwości użytkowych, co czyni go jednym z najbardziej rozpowszechnionych estrów w zastosowaniach przemysłowych, laboratoryjnych i konsumenckich. W kolejnej części przyjrzymy się bliżej jego fizykochemicznej reaktywności i znaczeniu w różnych dziedzinach chemii praktycznej.

Właściwości fizykochemiczne i zachowanie octanu etylu
Lotność, rozpuszczalność, temperatura wrzenia i palność
Octan etylu to związek, który wyróżnia się dużą lotnością, co oznacza, że szybko paruje w temperaturze pokojowej, nawet z otwartej butelki. Ta cecha czyni go doskonałym rozpuszczalnikiem w aplikacjach wymagających szybkiego wysychania powierzchni, np. w przemyśle farbiarskim i lakierniczym. Dzięki niskiemu ciśnieniu pary i stosunkowo niewielkiej masie cząsteczkowej, jego opary szybko się rozprzestrzeniają, co jednak wiąże się również z koniecznością zachowania ostrożności ze względu na palność i drażliwość układu oddechowego.
Temperatura wrzenia octanu etylu to około 77°C, co sprawia, że w warunkach normalnych zachowuje się jako ciecz, ale wymaga przechowywania w szczelnie zamkniętych opakowaniach, z dala od źródeł ciepła. Ma niską temperaturę zapłonu (ok. -4°C) i może tworzyć wybuchowe mieszaniny z powietrzem – dlatego w przemyśle używa się odpowiednich instalacji wentylacyjnych i przeciwwybuchowych.
Pod względem rozpuszczalności:
- bardzo dobrze rozpuszcza się w większości rozpuszczalników organicznych, takich jak aceton, benzen, eter dietylowy czy chloroform,
- ma ograniczoną rozpuszczalność w wodzie, ale wystarczającą do tworzenia jednorodnych mieszanin w określonych proporcjach (do ok. 8% wody w temp. 20°C).
Jego mieszalność i umiarkowana polarność pozwalają mu pełnić funkcję pośredniego rozpuszczalnika – łączyć fazy polarne i niepolarne, co jest często wykorzystywane w formulacjach lakierów, kosmetyków, farb i atramentów.
Reaktywność chemiczna – hydroliza, spalanie, udział w reakcjach organicznych
Z chemicznego punktu widzenia octan etylu jest dość stabilnym związkiem, ale posiada reaktywne wiązanie estrowe, które może ulegać różnym typom przemian. Jedną z najważniejszych reakcji, jakim podlega, jest hydroliza – czyli rozkład pod wpływem wody.
Hydroliza estrowa może przebiegać:
- w środowisku kwasowym (hydroliza kwaśna) – zachodzi powoli i jest reakcją równowagową:
CH₃COOC₂H₅ + H₂O ⇌ CH₃COOH + C₂H₅OH - w środowisku zasadowym (zmydlanie, hydroliza zasadowa) – przebiega nieodwracalnie:
CH₃COOC₂H₅ + NaOH → CH₃COONa + C₂H₅OH
Ta druga wersja reakcji jest podstawą produkcji mydeł oraz klasycznym przykładem reakcji estrowych w dydaktyce chemii. Zjawisko to jest także istotne z punktu widzenia trwałości produktu – w obecności wody i wysokiej temperatury octan etylu może się częściowo rozkładać, dlatego przechowuje się go w suchym środowisku.
W obecności płomienia octan etylu łatwo się spala, wydzielając dwutlenek węgla i wodę:
CH₃COOC₂H₅ + 5O₂ → 4CO₂ + 4H₂O
Ze względu na swoją lotność i palność jest klasyfikowany jako ciecz łatwopalna klasy I, co oznacza, że należy zachować szczególne środki ostrożności podczas magazynowania i stosowania.
Octan etylu może także brać udział w reakcjach organicznych jako:
- substrat w reakcjach transestryfikacji – wymiana fragmentu alkoholu w obecności kwasu lub zasady,
- reagent w reakcjach acylowania – np. związków fenolowych lub amin,
- rozpuszczalnik reakcyjny, szczególnie w syntezach wymagających umiarkowanej polarności i szybkiego odparowania.
W warunkach beztlenowych i w obecności silnych utleniaczy (np. nadtlenków) może ulegać reakcjom egzotermicznym lub niebezpiecznym rozkładom, dlatego nie należy go mieszać z utleniaczami bez kontroli laboratoryjnej.
Wpływ na zdrowie i bezpieczeństwo przy użytkowaniu
Octan etylu, mimo że jest powszechnie używany, wymaga odpowiedzialnego obchodzenia się. Jest to substancja lotna i łatwopalna, dlatego jej pary mogą:
- drażnić oczy i błony śluzowe,
- wywoływać kaszel, pieczenie w gardle, zawroty głowy, uczucie senności lub bóle głowy,
- prowadzić do podrażnień skóry przy długotrwałym kontakcie (działa odtłuszczająco),
- przy bardzo wysokich stężeniach – wpływać na układ nerwowy i funkcje oddechowe.
W związku z tym stosuje się:
- rękawice ochronne i okulary,
- dygestoria lub wentylację mechaniczną,
- pojemniki z atestem UN, przechowywane w chłodnym i zacienionym miejscu, z dala od źródeł zapłonu.
Zgodnie z klasyfikacją CLP, octan etylu ma przypisane oznaczenia:
- GHS02 (płomień) – łatwopalna ciecz i pary,
- GHS07 (wykrzyknik) – może powodować podrażnienia.
Pomimo tych zagrożeń, przy zachowaniu norm BHP i stosowaniu podstawowych środków ochrony indywidualnej, octan etylu jest związkiem bezpiecznym w użytkowaniu i wyjątkowo użytecznym w laboratoriach i przemyśle. W następnej części artykułu omówimy szczegółowo, w jakich branżach i procesach znajduje on zastosowanie.

Główne zastosowania octanu etylu w przemyśle i laboratoriach
Rozpuszczalnik w przemyśle farb, lakierów i tworzyw sztucznych
Jednym z najpowszechniejszych zastosowań octanu etylu jest jego funkcja jako rozpuszczalnik organiczny. Dzięki umiarkowanej polarności, lotności i zdolności do rozpuszczania szerokiego zakresu substancji organicznych, stał się on niezastąpiony w przemyśle farb i lakierów. Umożliwia:
- szybkie wysychanie powłok,
- równomierne rozprowadzenie składników na powierzchni,
- kompatybilność z wieloma żywicami i pigmentami.
Octan etylu stosowany jest m.in. w:
- farbach akrylowych i nitrocelulozowych,
- lakierach przemysłowych i samochodowych,
- tuszach drukarskich i graficznych,
- klejach kontaktowych i tapicerskich.
Jest ceniony za niską toksyczność w porównaniu z innymi rozpuszczalnikami organicznymi, takimi jak toluen czy ksylol, co pozwala na jego szersze zastosowanie nawet w produktach konsumenckich.
W branży tworzyw sztucznych octan etylu wykorzystywany jest do czyszczenia form i urządzeń, a także jako składnik niektórych mieszanek plastyfikujących i barwiących. Jego właściwości umożliwiają szybkie odparowanie bez pozostawiania osadów, co jest kluczowe w procesach przetwórczych.
Znaczenie w przemyśle perfumeryjnym i spożywczym
Dzięki swojemu intensywnemu, przyjemnemu zapachowi – przypominającemu gruszkę, ananasa lub inne owoce – octan etylu znalazł zastosowanie jako komponent zapachowy i aromatyzujący. W przemyśle perfumeryjnym używa się go jako:
- nośnika dla substancji zapachowych,
- rozcieńczalnika perfum,
- składnika tzw. nut głowy, które są pierwszymi odczuwanymi zapachami po aplikacji kosmetyku.
W produktach spożywczych – oczywiście w odpowiednio oczyszczonej wersji spełniającej normy farmakopealne i sanitarne – octan etylu stosowany jest jako dodatek aromatyzujący (E1504), np. w:
- napojach owocowych i gazowanych,
- słodyczach (gumy, lizaki, żelki),
- aromatyzowanych alkoholach i likierach,
- lodach i wyrobach cukierniczych.
Choć jego udział procentowy w gotowych produktach jest niewielki, wpływa znacząco na percepcję smaku i zapachu, dzięki czemu jest chętnie używany przez technologów żywności.
Użycie w laboratoriach chemicznych i w analizie instrumentalnej
W laboratoriach chemicznych, zarówno edukacyjnych, jak i badawczych, octan etylu pełni wiele ról, głównie jako:
- rozpuszczalnik reakcyjny – do prowadzenia syntez, w których wymagana jest umiarkowana polarność i niska lepkość,
- czynnik ekstrahujący – np. do izolacji produktów z wodnych roztworów reakcyjnych,
- substancja oczyszczająca – przy krystalizacji, płukaniu, dekantacji.
Octan etylu często wykorzystywany jest w:
- ekstrakcji ciecz–ciecz, jako składnik układów dwufazowych,
- chromatografii cienkowarstwowej (TLC) i kolumnowej (CC),
- preparatyce związków organicznych – dzięki łatwemu usuwaniu w procesie odparowania.
W analizie instrumentalnej (np. HPLC, GC), jego obecność może być ograniczona ze względu na wysoką lotność i możliwość zakłócenia sygnału, jednak jest używany w przygotowaniu próbek, myciu kolumn, ekstrakcji analitów i czyszczeniu sprzętu laboratoryjnego.
Ze względu na niską cenę, dostępność i kompatybilność z wieloma związkami organicznymi, octan etylu znajduje zastosowanie także w laboratoriach biotechnologicznych, środowiskowych, farmaceutycznych oraz w przemyśle chemii gospodarczej.
Jest też często stosowany w zestawach do edukacyjnych doświadczeń chemicznych, np. jako przykład estryfikacji lub jako modelowy rozpuszczalnik organiczny, który ilustruje zasady lotności, ekstrakcji i reakcji estrowych.
Octan etylu to jeden z najbardziej uniwersalnych estrów stosowanych w chemii i przemyśle. Łączy w sobie szeroki wachlarz właściwości: od przyjemnego zapachu i łatwości mieszania z innymi rozpuszczalnikami, przez względnie niską toksyczność, aż po łatwość syntezy i biodegradowalność. Jego wszechstronność sprawia, że związek ten odgrywa istotną rolę zarówno w laboratoriach badawczych, jak i w codziennych produktach użytkowych, których nawet nie kojarzymy z chemią.
FAQ octan etylu – najczęstsze pytania i odpowiedzi
Jaki jest wzór chemiczny octanu etylu?
Wzór chemiczny octanu etylu to CH₃COOC₂H₅ – jest to ester kwasu octowego i etanolu.
Jak powstaje octan etylu?
Octan etylu powstaje w wyniku reakcji estryfikacji kwasu octowego z etanolem w obecności kwasu siarkowego jako katalizatora.
Jakie są właściwości fizyczne octanu etylu?
To bezbarwna, łatwopalna ciecz o charakterystycznym owocowym zapachu, wrząca w temperaturze ok. 77°C.
Do czego używa się octanu etylu?
Octan etylu stosuje się jako rozpuszczalnik w przemyśle lakierniczym, farmaceutycznym, kosmetycznym i w laboratoriach chemicznych.
Czy octan etylu jest bezpieczny?
W niewielkich ilościach jest stosunkowo mało toksyczny, ale może działać drażniąco na oczy, skórę i drogi oddechowe – wymaga stosowania środków ostrożności.
- Wymiana instalacji elektrycznej – kiedy jest konieczna, jak przebiega i ile trwa? Kompletny poradnik 2026 - 23 grudnia, 2025
- Jak środki do suchej dezynfekcji poprawiają dobrostan zwierząt w hodowli? - 5 grudnia, 2025
- Lamele ścienne – praktyczny i estetyczny materiał do nowoczesnych aranżacji wnętrz - 30 października, 2025



Opublikuj komentarz