NH3 – właściwości amoniaku, zastosowania i znaczenie w przemyśle
Budowa i właściwości chemiczne NH₃
Struktura cząsteczki i hybrydyzacja atomu azotu
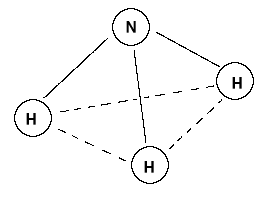
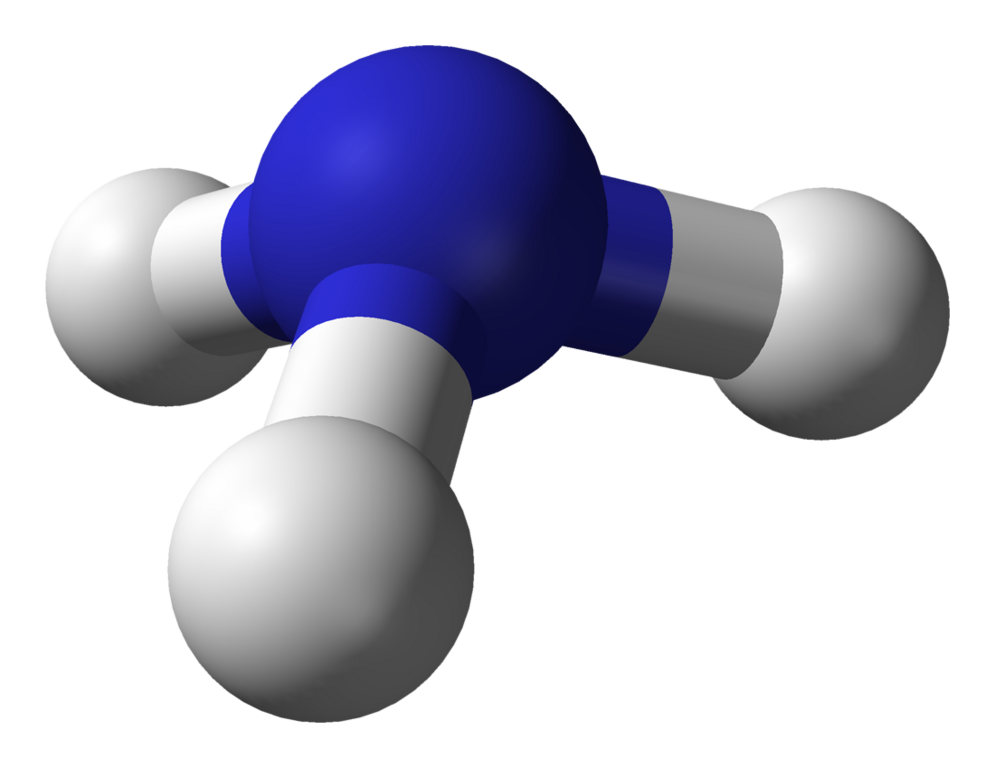
NH₃, czyli amoniak, to nieorganiczny związek chemiczny składający się z jednego atomu azotu (N) oraz trzech atomów wodoru (H). Cząsteczka ta przyjmuje kształt piramidy trygonalnej, ponieważ atom azotu wykorzystuje cztery orbitale hybrydyzowane sp³: trzy z nich tworzą wiązania sigma z atomami wodoru, a jeden zawiera wolną parę elektronową.
Obecność wolnej pary elektronowej wpływa na kąt między wiązaniami H–N–H, który wynosi około 107,3° – nieco mniej niż klasyczny kąt tetraedryczny (109,5°). Taka geometria nadaje cząsteczce polarność – atom azotu ma większą elektroujemność niż wodór, dlatego przesuwa wspólną parę elektronową w swoją stronę, tworząc moment dipolowy. W rezultacie NH₃ jest polarną cząsteczką, zdolną do tworzenia wiązania wodorowego, co ma istotne znaczenie dla jego właściwości fizycznych i chemicznych.
Właściwości fizyczne amoniaku
W warunkach normalnych amoniak jest bezbarwnym gazem o charakterystycznym, ostrym, duszącym zapachu, łatwo wyczuwalnym już przy bardzo niskich stężeniach. Podstawowe właściwości fizyczne NH₃ to:
- temperatura topnienia: –77,7°C
- temperatura wrzenia: –33,3°C
- masa molowa: 17,03 g/mol
- gęstość gazu: 0,771 kg/m³ (lżejszy od powietrza)
- rozpuszczalność w wodzie: bardzo dobra – 1 litr wody rozpuszcza około 700–900 litrów amoniaku (w 0°C)
Dzięki swojej polarności i zdolności do tworzenia wiązań wodorowych, amoniak doskonale rozpuszcza się w wodzie, tworząc roztwór zasadowy znany jako woda amoniakalna (NH₃·H₂O). Ten roztwór reaguje z wodą zgodnie z równaniem:
NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
To zrównoważenie czyni NH₃ klasyczną słabą zasadą Brønsteda, która może przyjmować proton, tworząc jon amonowy (NH₄⁺).
Reaktywność chemiczna NH₃
Amoniak to związek bardzo wszechstronny chemicznie. Jego główne właściwości chemiczne obejmują:
- Zdolność do tworzenia wiązań donorowo-akceptorowych – atom azotu z wolną parą elektronową może łączyć się z kationami metali, tworząc kompleksy, np. [Cu(NH₃)₄]²⁺, który ma intensywnie niebieską barwę i jest klasycznym przykładem kompleksu koordynacyjnego.
- Reakcje z kwasami – amoniak łatwo reaguje z kwasami nieorganicznymi, tworząc sole amonowe, np.: NH₃ + HCl → NH₄Cl
NH₃ + H₂SO₄ → (NH₄)₂SO₄
NH₃ + HNO₃ → NH₄NO₃ - Udział w reakcjach redoks – w wysokiej temperaturze i przy obecności utleniaczy NH₃ ulega utlenieniu, np. w procesie Ostwalda: 4 NH₃ + 5 O₂ → 4 NO + 6 H₂O
Ta reakcja zachodzi na katalizatorze platynowym i jest kluczowym etapem przemysłowej produkcji kwasu azotowego.
- Reakcje kondensacji i podstawienia – amoniak uczestniczy w reakcjach organicznych, takich jak aminowanie halogenków alkilowych, tworząc aminy pierwszorzędowe.
Wiązania wodorowe i oddziaływania międzycząsteczkowe
Ze względu na swój kształt i polarność, NH₃ może tworzyć wiązania wodorowe – zarówno z innymi cząsteczkami amoniaku, jak i z cząsteczkami wody. To wyjaśnia:
- jego stosunkowo wysoką temperaturę wrzenia,
- dobrą rozpuszczalność w wodzie i alkoholach,
- zdolność do tworzenia silnych roztworów alkalicznych,
- jego rolę jako rozpuszczalnika w niektórych reakcjach chemicznych (np. reakcje sodu z wodą amoniakalną).
W stanie ciekłym, pod odpowiednim ciśnieniem, NH₃ wykazuje właściwości podobne do wody – może służyć jako alternatywny rozpuszczalnik w niektórych reakcjach nieorganicznych i organicznych, zwłaszcza tam, gdzie obecność wody byłaby niepożądana.
NH₃ jako zasada Brønsteda i nukleofil
Amoniak jest typową słabą zasadą Brønsteda, która łatwo przyłącza proton, ale nie dysocjuje całkowicie. Jest także nukleofilem – związek ten chętnie atakuje centra elektrofilowe w cząsteczkach, co pozwala mu na udział w wielu reakcjach syntezy organicznej, takich jak:
- tworzenie amidów,
- reakcje z izocyjanianami i kwasami karboksylowymi,
- synteza amin aromatycznych i alifatycznych.
Dzięki tym właściwościom NH₃ jest nie tylko surowcem przemysłowym, lecz także reagentem syntetycznym o dużym znaczeniu laboratoryjnym.
W kolejnej części artykułu przyjrzymy się praktycznym zastosowaniom NH₃, zarówno w przemyśle nawozowym i chłodniczym, jak i w laboratoriach, gospodarstwach domowych oraz w energetyce przyszłości.
Zastosowanie NH₃ w różnych dziedzinach przemysłu i życia codziennego
Amoniak w przemyśle chemicznym i produkcji nawozów
Najważniejszym zastosowaniem NH₃ jest jego rola jako surowca wyjściowego w przemyśle chemicznym, zwłaszcza przy produkcji nawozów azotowych. Rocznie na świecie wytwarza się setki milionów ton amoniaku, z czego zdecydowana większość trafia do rolnictwa w formie:
- azotanu amonu (NH₄NO₃),
- moczniku (CO(NH₂)₂),
- siarczanu amonu ((NH₄)₂SO₄),
- fosforanu amonu (NH₄H₂PO₄ i (NH₄)₂HPO₄).
NH₃ jest w tych przypadkach źródłem łatwo przyswajalnego azotu, niezbędnego do syntezy białek, enzymów i kwasów nukleinowych w roślinach. Amoniak stosowany jest również bezpośrednio jako roztwór wodny (woda amoniakalna) do nawożenia gleb zasadowych oraz w rolnictwie precyzyjnym w postaci bezwodnej – podawany jest wtedy w postaci ciekłej bezpośrednio do gleby, gdzie szybko ulega przemianom mikrobiologicznym.
Oprócz nawozów, amoniak bierze udział w produkcji wielu związków azotowych:
- kwasu azotowego (HNO₃) – kluczowego do dalszej syntezy barwników, materiałów wybuchowych i tworzyw sztucznych,
- hydrazyny (N₂H₄) – stosowanej jako paliwo rakietowe i składnik farmaceutyków,
- amin, amidów, nitryli i innych związków używanych w przemyśle farmaceutycznym i kosmetycznym.
NH₃ jako czynnik chłodniczy i techniczny gaz przemysłowy
Dzięki swoim właściwościom fizycznym – przede wszystkim niskiej temperaturze wrzenia (-33,3°C) – amoniak znalazł szerokie zastosowanie jako czynnik chłodniczy, oznaczany symbolem R717. Jest wykorzystywany w:
- instalacjach chłodniczych przemysłowych – chłodnie, magazyny żywności, przetwórstwo mięsa i ryb, mleczarnie,
- produkcji lodu technologicznego,
- systemach klimatyzacji dużych obiektów przemysłowych,
- lodówkach absorpcyjnych (np. w kamperach, hotelach, chłodniach kontenerowych).
Amoniak jest wydajnym i tanim czynnikiem chłodniczym, jednak z uwagi na jego toksyczność i charakter drażniący, wymaga stosowania specjalnych zabezpieczeń, szczelnych instalacji i czujników wykrywania wycieków.
W przemyśle chemicznym NH₃ stosuje się również jako gaz procesowy:
- do neutralizacji odpadów kwaśnych,
- w procesach redukcyjnych,
- jako reduktor tlenków azotu (NOₓ) w układach oczyszczania spalin – tzw. SCR (Selective Catalytic Reduction),
- do produkcji włókien syntetycznych, takich jak kapron i nylon.
Zastosowania NH₃ w laboratoriach, medycynie i gospodarstwie domowym
W laboratoriach chemicznych amoniak znajduje szerokie zastosowanie jako:
- reagent zasadowy w reakcjach zobojętniania i tworzenia soli,
- rozpuszczalnik do syntez nieorganicznych,
- środek kompleksujący dla metali przejściowych (np. jony Cu²⁺, Ag⁺, Zn²⁺),
- źródło azotu w reakcjach organicznych.
W laboratoriach analitycznych stosuje się również wodę amoniakalną do:
- wykrywania kationów metali (np. osady związków srebra, miedzi),
- przygotowywania buforów o zasadowym pH,
- testów jakościowych – np. rozpoznawania barwy roztworów kompleksów.
W zastosowaniach medycznych i higienicznych NH₃ był dawniej używany jako:
- środek pobudzający w przypadkach omdleń – w postaci wdychanego amoniaku,
- składnik czyszczących roztworów dezynfekujących,
- składnik niektórych preparatów przeciwgrzybiczych i przeciwbakteryjnych (obecnie rzadziej ze względu na bezpieczeństwo i skuteczniejsze alternatywy).
W gospodarstwach domowych woda amoniakalna (ok. 10% roztwór NH₃) używana jest jako silny środek czyszczący, szczególnie do:
- odtłuszczania powierzchni kuchennych,
- usuwania zabrudzeń z szyb i luster,
- czyszczenia tapicerki i dywanów,
- neutralizacji zapachów zwierząt domowych.
Ze względu na intensywny zapach i działanie drażniące, produkty te są coraz częściej wypierane przez mniej uciążliwe środki czystości.
NH₃ w energetyce i jako przyszłościowe paliwo
Coraz więcej uwagi poświęca się również zastosowaniom amoniaku jako nośnika energii, a nawet jako alternatywnego paliwa zeroemisyjnego. Amoniak może być spalany bezpośrednio lub używany jako źródło wodoru w procesach takich jak:
- dekompozycja NH₃ → ½ N₂ + 3/2 H₂,
- spalanie w silnikach spalinowych i turbinach,
- napęd ogniw paliwowych z wykorzystaniem wodoru pochodzącego z amoniaku.
Zaletą takiego rozwiązania jest:
- brak emisji CO₂,
- możliwość magazynowania i transportu w formie ciekłej pod niskim ciśnieniem,
- istniejąca infrastruktura do przechowywania NH₃ (zbiorniki, cysterny, rurociągi).
Amoniak ma więc szansę odegrać kluczową rolę w transformacji energetycznej, szczególnie jako paliwo dla statków, elektrowni szczytowo-pompowych, przemysłu ciężkiego czy krajów rozwijających wodór jako magazyn energii (np. Japonia, Korea Południowa).
W kolejnej części przyjrzymy się toksyczności NH₃, zasadom jego bezpiecznego przechowywania i wpływowi na środowisko, w tym jego roli w cyklu azotowym oraz jako potencjalnemu zagrożeniu dla zdrowia ludzi i ekosystemów.
Bezpieczeństwo, przechowywanie i wpływ NH₃ na zdrowie i środowisko
Toksyczność amoniaku i wpływ na organizm człowieka
Amoniak (NH₃), mimo szerokiego zastosowania, jest związkiem toksycznym i drażniącym, szczególnie w formie gazowej lub stężonych roztworów. Działa silnie na drogi oddechowe, błony śluzowe oraz skórę, a jego ostry, przenikliwy zapach jest wyczuwalny już przy stężeniu rzędu 5 ppm (cząstek na milion).
Objawy narażenia na NH₃ zależą od jego stężenia i czasu ekspozycji:
- 5–20 ppm – drażniący zapach, lekki dyskomfort nosa i oczu
- 25–50 ppm – podrażnienie gardła, kaszel, łzawienie
- 100–250 ppm – silne pieczenie oczu, skurcz krtani, trudności w oddychaniu
- >500 ppm – poważne oparzenia dróg oddechowych, ryzyko obrzęku płuc
- >2000 ppm – działanie śmiertelne w ciągu kilku minut
W kontakcie ze skórą lub oczami amoniak może powodować:
- oparzenia chemiczne,
- zaczerwienienie i obrzęk,
- uszkodzenie rogówki i trwałe pogorszenie wzroku.
W razie ekspozycji na NH₃:
- należy natychmiast opuścić strefę skażenia,
- w przypadku kontaktu ze skórą lub oczami – płukać dużą ilością wody przez co najmniej 15 minut,
- w razie wdychania – zapewnić świeże powietrze, unikać wysiłku i niezwłocznie skontaktować się z lekarzem,
- przy ciężkim zatruciu – wezwać pogotowie i zastosować tlenoterapię.
Dlatego w miejscach pracy z NH₃ stosuje się:
- detektory amoniaku,
- systemy wentylacyjne,
- maski z pochłaniaczami gazów (klasa K),
- odzież ochronną i rękawice chemoodporne.
Zasady przechowywania i transportu NH₃
Amoniak ze względu na swoje właściwości chemiczne i fizyczne musi być przechowywany zgodnie z określonymi przepisami dotyczącymi substancji niebezpiecznych. W zależności od formy, w jakiej występuje (gaz, ciecz, roztwór wodny), stosuje się różne środki bezpieczeństwa.
Podstawowe zasady magazynowania NH₃:
- przechowywanie w ciśnieniowych zbiornikach stalowych, odpornych na działanie zasadowe,
- temperatura przechowywania poniżej 30°C, z dala od źródeł ciepła,
- ochrona przed promieniowaniem UV i uszkodzeniami mechanicznymi,
- systemy bezpieczeństwa – zawory nadciśnieniowe, czujniki wycieków, strefy ochronne,
- dobre oznakowanie zbiorników: symbol ostrzegawczy (substancja żrąca, gaz pod ciśnieniem, toksyczna), numer UN: 1005,
Transport amoniaku odbywa się najczęściej w:
- cysternach samochodowych lub kolejowych,
- butlach stalowych do zastosowań laboratoryjnych,
- rurociągach przemysłowych na krótkie odległości.
W Unii Europejskiej i wielu krajach świata amoniak podlega przepisom ADR (transport drogowy materiałów niebezpiecznych), a przewóz wymaga stosownych uprawnień i certyfikacji.
W domowych i warsztatowych zastosowaniach woda amoniakalna powinna być przechowywana:
- w oryginalnych, szczelnych opakowaniach z polietylenu lub szkła,
- w chłodnym, dobrze wentylowanym pomieszczeniu,
- z dala od dzieci, zwierząt i źródeł ognia.
NH₃ w środowisku naturalnym i jego cykl w przyrodzie
Amoniak odgrywa bardzo istotną rolę w cyklu azotu, będąc produktem:
- deaminacji białek w organizmach żywych,
- rozkładu materii organicznej,
- fermentacji moczu i odchodów zwierząt,
- procesów mikrobiologicznych w glebie i wodzie.
Naturalnie NH₃ obecny jest:
- w atmosferze (śladowe ilości, głównie z rolnictwa),
- w glebie (produkowany przez bakterie amonifikujące),
- w wodach gruntowych i powierzchniowych (jako produkt rozkładu odpadów biologicznych).
Jednak nadmierne emisje amoniaku, zwłaszcza z przemysłu rolniczego (obornik, gnojowica, nawozy), prowadzą do:
- zakwaszenia gleby,
- eutrofizacji zbiorników wodnych,
- powstawania pyłów wtórnych w atmosferze (PM2.5),
- zaburzenia bioróżnorodności w ekosystemach.
Wysokie stężenia NH₃ w glebie lub wodzie mogą działać toksycznie na:
- rośliny (poparzenia liści, zahamowanie wzrostu),
- organizmy wodne (zatrucie ryb, planktonu),
- owady i mikroorganizmy glebowe, zaburzając równowagę mikrobiologiczną.
Z tego względu w krajach Unii Europejskiej obowiązują limity emisji NH₃, a rolnicy muszą:
- stosować precyzyjne dawkowanie nawozów azotowych,
- prowadzić hermetyzację zbiorników na gnojowicę,
- rozsiewać nawozy w sposób ograniczający emisję gazów (np. wstrzykiwanie w glebę).
W środowisku naturalnym amoniak podlega przemianom biologicznym, m.in. przez bakterie nitryfikacyjne, które przekształcają go w:
- azotyny (NO₂⁻),
- azotany (NO₃⁻) – przyswajalne dla roślin,
- a następnie w procesie denitryfikacji do azotu cząsteczkowego (N₂), który wraca do atmosfery.
Te naturalne procesy pozwalają przyrodzie na samoregulację zawartości NH₃, jednak przy zbyt dużym obciążeniu antropogenicznym (rolnictwo, przemysł) dochodzi do trwałych zaburzeń tego cyklu.
NH₃ jest więc substancją o dwóch obliczach – z jednej strony niezbędną w rolnictwie i przemyśle, z drugiej – potencjalnie niebezpieczną dla zdrowia i środowiska. Jego wykorzystanie wymaga wiedzy, precyzji i odpowiedzialności, by mógł służyć rozwojowi bez generowania ryzyka.
FAQ NH3 – najczęściej zadawane pytania
Co to jest NH3?
NH3 to wzór chemiczny amoniaku – bezbarwnego, drażniącego gazu o charakterystycznym zapachu, będącego związkiem azotu i wodoru.
Jakie właściwości ma NH3?
NH3 ma silny, ostry zapach, jest gazem lżejszym od powietrza, dobrze rozpuszcza się w wodzie i działa zasadowo.
Do czego używa się NH3?
NH3 wykorzystuje się m.in. do produkcji nawozów azotowych, jako czynnik chłodniczy, środek czyszczący oraz w przemyśle chemicznym i farmaceutycznym.
Czy NH3 jest szkodliwy?
Tak, amoniak w dużych stężeniach działa drażniąco na oczy, skórę i drogi oddechowe. Może być toksyczny przy wdychaniu i kontaktach skórnych.
Jak bezpiecznie przechowywać NH3?
Amoniak przechowuje się w szczelnych, ciśnieniowych zbiornikach z odpowiednim oznakowaniem, w chłodnych i dobrze wentylowanych pomieszczeniach.
- LEED – przewodnik po certyfikacji zielonych budynków dla inwestorów, architektów i najemców - 24 września, 2025
- Elektrociepłownia geotermalna – jak działa, kiedy się opłaca i gdzie ma sens - 24 września, 2025
- Zielony Ład – strategia transformacji gospodarki, energia i konkurencyjność - 24 września, 2025




Opublikuj komentarz